ГОУ ВПО «Владивостокский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Кафедра биологической химии
Комплект учебно-методических материалов к
Учебно-методическому комплексу «БИОЛОГИЧЕСКАЯ ХИМИЯ»
Методические рекомендации
По проведению лабораторно-практических занятий
060108 – Фармация, курс 2, семестр 4
060101 – Лечебное дело, курс 2, семестр 3
060103 – Педиатрия, курс 2, семестр 3
060104 – Медико-профилактическое дело, курс 2, семестр 3
Утверждены
на методическом совещании кафедры
от 18 ноября 2008 г.
Протокол № 59
Владивосток 2008
Лабораторно-практическое занятие № 1
Тема: «Строение и функции белков».
Мотивация: Основные вопросы темы необходимы для понимания проблем практической и теоретической медицины и фармации:
· протеинопатии как следствие врожденных нарушений структуры и функций белков (гемоглобинопатии, талассемии, ферментопатии);
· влияние негативных факторов загрязнения окружающей среды на структуру и функции белков (экологические аспекты)
|
|
|
· значение методов выделения и очистки белков для разработки способов получения белковых препаратов из природных источников и применение их в профилактике и лечении заболеваний (g-глобулины, ферменты, интерфероны), в функционировании аппарата “искусственная почка” (гемодиализ)
· использование белков в качестве антидотов при пероральном отравлении солями тяжелых металлов
· Определение концентрации белков в тканях и биологических жидкостях с целью диагностики и контроля лечения заболеваний.
Цель обучения, воспитания и развития: Уметь применять знания о структурном и функциональном многообразии белков для объяснения основных закономерностей биологического функционирования белков, причин и следствий изменения белкового состава организма в онтогенезе и при болезнях, природы молекулярных болезней. Применять знания о свойствах белков для их определения и идентификации в биологических жидкостях (кровь, моча, лимфа, ликвор, слюна) с целью диагностики заболеваний и контроля лечения.
Задачи обучения, воспитания и развития: студент должен
Знать
· факторы повреждения структуры и функций белков
· факторы формирования нативной конформации белковой молекулы
· основные закономерности функционирования белковой молекулы
Уметь
· объяснять значения терминов: протеинопатия, гемоглобинопатия, серповидно-клеточная анемия, прионы, шапероны
· писать формулы следующих аминокислот и образованных из них пептидов: ГЛИ, АЛА, ФЕН, АСП, ГЛУ, МЕТ, ЦИС, ГИС, СЕР, ЛИЗ.
3. Знать химизм: образование пептидной связи
|
|
|
Педагогическое диагностирование исходного уровня ЗУН (тесты):
1. Найти соответствие:
| А. Ферритин Б. Кератин В. Казеин Г. Хитин Д. Нуклеопротеид | а) фосфопротеид, у которого фосфорная кислота присоединя- ется к молекуле белка сложноэфирной связью по месту гидро- ксильных групп оксиаминокислот; б) белок, содержащий в своем составе 20% железа, являющий- ся депо последнего в организме животных; в) непременный компонент ядерного материала и цитоплазмы; г) кутикулярный гликопротеид; д) содержит большое количество цистеина. |
2. Выберите правильный ответ. Что является структурным элементом простых белков:
А. Мононуклеотиды.
Б. Глюкоза.
В. Аминокислоты.
Г. Глицерин.
3. Подберите к каждой из аминокислот соответствующее свойство радикала (подберите к буквам соответствующие цифры):
| 1. Триптофан. 2. Аспарагиновая кислота 3. Цистеин 4. Лейцин 5. Аргинин. 6. Серин. | А. Гидрофильный, положительно заряженный Б. Гидрофильный, отрицательно заряженный В. Гидрофильный, незаряженный Г. Гидрофобный |
4. Выберите несколько правильных ответов. Какой метод можно применить для фракционирования белков:
А. Кристаллизацию.
Б. Осаждение кислотами и щелочами.
В. Электрофорез.
Г. Высаливание.
5. Выберите правильный ответ. Незаменимыми аминокислотами являются:
а) лиз, три, фен б) сер, гли, гис
в) асп, ала, тре г) про, оксипро, арг
д) глу, цис, тир
6. Установите соответствие:
| а. Первичная структура б. Вторичная структура в. Третичная структура | 1) стабилизируется водородными связями между атомами пептидного остова 2) в ее формировании принимают участие гидрофобные взаимодействия радикалов 3) фиксируется ковалентными связями между амино- и карбоксильными группами аминокислот |
7. Выберите правильный ответ. Коллаген – единственный белок, в состав которого входит
А) орнитин б) аргинин
в) изолейцин г) 5-окситриптофан
д) оксипролин
8. Выберите правильный ответ. Наибольшие изменения в структуре и свойствах гемоглобина произойдут при мутации, связанной со следующей заменой аминокислот:
а) глутаминовая кислота – аспарагин б) глутаминовая кислота – лизин
в) глутаминовая кислота – аргинин г) глутаминовая кислота – валин
9. Выберите правильный ответ. Следствием нарушения первичной структуры гемоглобина является:
а) диспротеинемия б) метгемоглобинемияв
в) гипопротеинемия г) серповидно-клеточная анемия
д) железодефицитная анемия
10. Выберите правильный ответ. Незаменимые аминокислоты
1. Определяют видовые различия белков
2. Не синтезируются в организме
3. Способствуют созданию гидратной оболочки
4. Определяют биологические свойства белков
5. Определяют заряд белковой молекулы
Решить задачи
Задача 1. В молекулах целого ряда белков содержится большое число остатков цистина. При этом наблюдается корреляция между механическими и химическими свойствами белков (прочностью на разрыв, вязкостью, твердостью, устойчивостью к действию денатурирующих факторов, температурным воздействиям). Например, глутенин определяет вязкость и эластичность теста, приготовленного из пшеничной муки; твердость и прочность панциря черепахи определяет кератин. Какова молекулярная основа наблюдаемой корреляции между содержанием цистина и свойствами белка?
Задача 2. В крови студента одной из африканских стран, поступившего в больницу по поводу одышки, головокружения, учащенного сердцебиения и болей в конечностях, при анализе крови были найдены эритроциты, имеющие форму серпа. Объясните причину развития данного заболевания. Для ответа на вопрос объясните:
а) какое строение имеет гемоглобин А;
б) какие изменения в структуре белка привели к образованию патологической формы;
|
|
|
в) как называется такая форма гемоглобина;
г) почему изменяется форма и функция эритроцитов.
Задача 3. На рисунке представлена схема белка, состоящего из одной полипептидной цепи и имеющего активный центр, а также структуры 4-х лигандов.
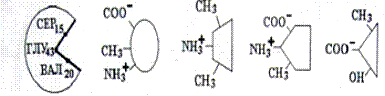
Выберите из 4-х представленных лигандов один, который с наибольшей вероятностью будет взаимодействовать с активным центром белка. Для этого:
а) напишите формулы аминокислот, входящих в состав активного центра.
б) объясните, чем обусловлена специфичность связывания белка с лигандом;
в) какие связи возникают между выбранным вами лигандом и активным центром.
в) дайте определение, что такое «активный центр» белка и объясните, на каком уровне структурной организации он формируется? Какую роль играет активный центр в функционировании белка. Какое значение имеет первичная структура белка в формировании активного центра. Приведите примеры влияния первичной структуры на активность белков.
Пример решения задач: В 1949 году Лайнус Полинг с сотрудниками доказали, что в основе заболевания серповидноклеточной анемией лежит изменение первичной структуры белка. Назовите этот белок и на его примере расскажите о зависимости конформации белков и их функций от первичной структуры.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.
|
|
|
В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
ДНК à Первичная структура белка à Вторичная структура белка à Третичная структура белка à Образование уникальной формы активного центра à Избирательное связывание лигандов à Специфическая функция белка
Задание для СДС во внеучебное время:
Заполнить таблицы :
 2015-04-30
2015-04-30 2168
2168







