1.Аминокислотные остатки в пептидной цепи белков чередуются не случайным образом, а расположены в определенном порядке. Линейная последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой белка.
2. Первичная структура каждого индивидуального белка закодирована в молекуле ДНК (участке, называемом геном) и реализуется в ходе транскрипции (переписывания информации на мРНК) и трансляции (синтез пептидной цепи).
3. Каждый из 50 000 индивидуальных белков организма человека имеет уникальную для данного индивидуального белка первичную структуру. Все молекулы индивидуального белка (например, альбумина) имеют одинаковое чередование аминокислотных остатков, отличающее альбумин от любого другого индивидуального белка.
4. Последовательность аминокислотных остатков в пептидной цепи можно рассматривать как
форму записи некоторой информации.
Эта информация диктует пространственную укладку длинной линейной пептидной цепи в более компактную трехмерную структуру.
10. Глиценрин образует азеотропные смеси с нафталином, рядом его производных и некоторыми другими соединениями.
Благодаря наличию в молекуле трех ОН-групп глицерин дает три ряда производных, причем моно- и дипроизводные могут существовать в виде двух структурных изомеров, а производные глицерина типа СН2ХСНОНСН2ОН или СН2ХСНХСН2ОН - в виде оптических изомеров. Глицерин образует три ряда металлических производных - глицератов, причем они получаются даже при взаимодействии глицерина с оксидами тяжелых металлов, например CuO. Это свидетельствует о том, что кислотные свойства у глицерина выражены значительно сильнее, чем у одноатомных спиртов. При взаимодействии глицерина с галогеноводородными кислотами или галогенидами фосфора образуются моно- или дигалогенгидрины, с I2 и Р-1,2,3-трииодпропан (нестойкое соединение, распадающееся на йод и аллилиодид), с неорганическими и карбоновыми кислотами - полные и неполные сложные эфиры, при дегидратации - акролеин. Как и все спирты, глицерин окисляется; в зависимости от природы окислителя и условий можно получить глицериновый альдегид СН2(ОН)СН(ОН)СНО, глицериновую кислоту СН2(ОН)СН(ОН)СООН, тартроновую кислоту (НООС)2СНОН, дигидроксиацетон НОСН2СОСН2ОН, мезоксалевую кислотуту (НООС)2СО; под действием КМnО4 или К2Сr2О7 глицерин окисляется до СО2 и Н2О.
Глицерин содержится в природных жирах и маслах в виде смешанных триглицеридов карбоновых кислот. В промышленности его получают омылением пищевых жиров, расщепляющихся на глицерин и жирные кислоты в присутствии различных катализаторов (кислот, щелочей, ферментов). Все большее значение приобретают синтетические методы, один из которых (хлоргидринный) получил промышленное применение. Он включает 4 стадии: высокотемпературное хлорирование пропилена до аллилхлорида; взаимодействие последнего с хлорноватистой кислотой НОСl с получением водных растворов дихлоргидринов глицерина; дегидрохлорирование дихлоргидринов до эпихлоргидрина; щелочной гидролиз последнего до глицерина. Метод характеризуется большим количеством загрязненных сточных вод (до 60 м3 на 1 т глицерина) и непроизводительным расходом хлора. На производство 1 т глицерина идет до 0,8-1 т пропилена и до 2,8 т Сl2.
Известны бесхлорные методы синтеза, также основанные на использовании в качестве исходного сырья пропилена. Наиболее перспективно эпоксидирование пропилена гидропероксидами или надкислотами и изомеризация полученного пропиленоксида в аллиловый спирт с дальнейшим превращением его в глицерин.
Хранят глицерин в герметичных емкостях из алюминия или нержавеющей стали под азотной подушкой. Транспортируют в алюминиевых или стальных железнодорожных цистернах и бочках.
11 Среди возможных способов получения аминокислот в промышленном масштабе существуют микробиологический и химический. В современной мировой практике с помощью микробиологического синтеза получают около 60% производимых аминокислот. Значительный интерес к данному способу получения аминокислот, обусловлен прежде всего его высокими технико-экономическими показателями, а также возможностью получения чистых индивидуальных аминокислот, пригодных к использованию в пищевой и медицинской промышленности. Из 20 аминокислот, составляющих белки, восемь не могут синтезироваться в организме человека и животных; эти незаменимые аминокислоты должны содержаться в пище или кормах. Особенно важны лизин и метионин. Метионин производится синтетически, тогда как 80% лизина – биосинтетически. Микроорганизмы обычно синтезируют каждую из аминокислот в определенных количествах, обеспечивая тем самым синтез специфических белков. Это объясняется тем, что контроль за скоростью биосинтеза каждой аминокислоты осуществляется на уровне генов. Такой контроль исключает перепроизводство аминокислот. При микробиологическом синтезе специально подобранные, селекционированные, а иногда и сконструированные методами генетической инженерии штаммы-продуценты в процессе жизнедеятельности осуществляют сверхсинтез аминокислот, т.е. производят их в количествах, намного превышающих потребности самих клеток. Пути биосинтеза отдельных аминокислот были изучены с применением метода изотопных меток. Метод изотопной метки основан на том, что к растущей культуре микроорганизма добавляют меченную аминокислоту, которая включается в синтез белка.
12 ВИТАМИН А-группа природных соединений - производных в-ионона (формула I). Кристаллические вещества, не растворимы в воде, хорошо растворяются в органических растворителях. Разлагаются при взаимодействии с О2. Склонны к цис-транс-изомеризации, особенно по связям 11 и 13. Важнейшие представители: ретинол (витамин А1, витамин А1-спирт, эксерофтол; формула II, R = СН2ОН), ретиналь (ретинен, ретинальдегид, витамин A1-альдегид; II, R = СНО) и ретиноевая кислота (витамин А2, II, R == СООН). У всех соединений, кроме 11-цис-ретиналя, присутствующего в сетчатке глаз, все двойные связи имеют транс-конфигурацию. [11]
В организме в результате действия фермента 15,15-оксигеназы на в- каротин (главный провитамин витамина А; III) образуются две молекулы ретиналя. Незначительная часть его окисляется до ретиноевой кислоты, которая поступает в кровоток, а основная часть восстанавливается до ретинола. Последний этерифицируется пальмитиновой или другими высшими жирными кислотами и депонируется в печени. В результате последующего гидролиза эфиров свободный витамин секретируется из печени в кровоток. Там он образует комплекс со специфическим ретинолсвязывающим белком (мол. м. 22000), который обеспечивает его солюбилизацию, защиту от окисления и направленный перенос в ткани. Связанный ретинол в отличие от свободного не обладает мембранолитическим действием. [11]
СВОЙСТВА СОЕДИНЕНИЙ, ВХОДЯЩИХ В ГРУППУ ВИТАМИНА А
Витамин А включает ряд близких по структуре соединений:
· ретинол (витамин А-спирт, витамин А1, аксерофтол);
· дегидроретинол (витамин А2);
· ретиналь (ретинен, витамин А-альдегид);
· ретинолевая кислота (витамин А-кислота);
· эфиры этих веществ и их пространственные изомеры.
Дегидроретинол
Ретиналь (R = -CHO);
ретинол (R = -CH2OH);
ретиноевая кислота (R = -COOH)
Ретинол (истинный витамин A, транс-9,13-Диметил-7-(1,1,5-триметилциклогексен-5-ил-6)-нонатетраен-7,9,11,13-ол) -- жирорастворимый витамин, антиоксидант. В чистом виде нестабилен, встречается только в продуктах животного происхождения. Поэтому производится и используется в формах ретинола ацетата и ретинола пальмитата. Был открыт в 1913 году двумя независимыми группами ученых (Мак-Коллут -- Дэвис и Осборн). Стал первым из открытых витаминов, поэтому его соединение стало обозначаться буквой A в соответствии с алфавитной номенклатурой.[1]
Ретинол является жирорастворимым, поэтому для его усвоения пищевым трактом требуются жиры, а также минеральные вещества. В организме его запасы остаются достаточно долго, чтобы не пополнять его запасы каждый день. Существует две формы этого витамина: это готовый витамин А (ретинол) и провитамин А (каротин), который в организме человека превращается в витамин A, поэтому его можно считать растительной формой витамина A. Витамин A имеет бледно-желтый цвет, который образуется из красного растительного пигмента бета-каротина.[1]
Каротин, впервые был выделен из моркови (от лат. carota - морковь). Известны 3 типа каротинов: б-, в- и г-каротины, отличающиеся друг от друга химическим строением и биологической активностью. Наибольшей биологической активностью обладает в-каротин, поскольку он содержит два в-иононовых кольца и при распаде в организме из него образуются две молекулы витамина А.
б-Каротин
При окислительном распаде б- и г-каротинов образуется только по одной молекуле витамина А, поскольку эти провитамины содержат по одному в-иононовому кольцу. Расщепление каротинов на молекулы витамина А происходит преимущественно в кишечнике под действием специфического фермента в-каротин-диоксигеназы (не исключена возможность аналогичного превращения и в печени) в присутствии молекулярного кислорода. При этом образуются 2 молекулы ретиналя, которые под действием специфической кишечной редуктазы восстанавливаются в витамин А. Степень усвоения каротинов и свободного витамина А зависит как от содержания жиров в пище, так и от наличия свободных желчных кислот, являющихся абсолютно необходимыми соединениями для процесса всасывания продуктов распада жиров. [8]
Более подробно выяснено значение витамина А в процессе свето-ощущения. В этом важном физиологическом процессе большую роль играет особый хромолипопротеин - сложный белок родопсин, или зрительный пурпур, являющийся основным светочувствительным пигментом сетчатки, в частности палочек, занимающих ее периферическую часть.
Установлено, что родопсин состоит из липопротеина опсина и простети-ческой группы, представленной альдегидом витамина A1(ретиналь); связь между ними осуществляется через альдегидную группу витамина и свободную е-NH2-группу лизина молекулы белка с образованием шиффова основания. На свету родопсин расщепляется на белок опсин и ретиналь; последний подвергается серии конформационных изменений и превращению в транс-форму. С этими превращениями каким-то образом связана трансформация энергии световых лучей в зрительное возбуждение - процесс, молекулярный механизм которого до сих пор остается загадкой. В темноте происходит обратный процесс - синтез родопсина, требующий наличия активной формы альдегида - 11-цис-ретиналя, который может синтезироваться из цис-ретинола, или транс-ретиналя, или транс-формы витамина А при участии двух специфических ферментов - дегидрогеназы и изомеразы. Более подробно цикл превращений родопсина в сетчатке глаза на свету и в темноте можно представить в виде схемы:
Таким образом, под действием кванта света родопсин через ряд промежуточных продуктов («оранжевый» и «желтый» белки) распадается на опсин и алло-транс-ретиналь, представляющий собой неактивную форму альдегида витамина А. Имеются сведения, что алло-транс-ретиналь может частично превращаться в активный 11-цис-ретиналь под влиянием света.
Источники витамина А
Накопление запасов витамина А происходит в печени. Несмотря на то, что витамин А обнаружен только в продуктах животного происхождения, таких как: рыбий жир, жир молока, сливочное масло, сливки, творог, сыр, яичный желток, жир печени и жир других органов - сердца, мозга, в организме человека (в кишечной стенке и печени) витамин А может образовываться и из каротина, который широко распространен в растительных продуктах. Наибольшей активностью обладает b-каротин (провитамин А). Считается, что 1 мг b-каротина по эффективности соответствует 0,17 мг витамина А. Много содержится каротина в рябине, абрикосах, шиповнике, черной смородине, облепихе, желтых тыквах, арбузах, в красном перце, шпинате, капусте, ботве сельдерея, петрушке, укропе, кресс-салате, моркови, щавеле, зеленом луке, зеленом перце, крапиве, одуванчике, клевере. Отмечают, что количество витаминов изменяется в соответствии с окраской продуктов в красновато-желтый цвет: чем интенсивнее эта окраска, тем больше витамина в продукте. Количество витамина в жирах зависит от состава пищи, которой питается животное. Если пища животного богата витаминами или провитаминами, то жир его содержит высокий процент витамина; так, рыбий жир в 100 раз богаче витамином А, чем сливочное масло, потому что растительный и животный планктон, которым питаются рыбы, очень богат витамином А. Суточная потребность взрослого человека в витамине А (в пересчете на ретинол) - 1 мг, беременных и кормящих женщин - 1,25-1,5 мг, детей первого года жизни - 0,4 мг. Потребность повышается в период развития и роста, в период беременности, а также при диабете и заболеваниях печени.
13. Строение белков
Белки - высокомолекулярные органические соединения, состоящие из остатков б-аминокислот.
В состав белков входят углерод, водород, азот, кислород, сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь.
Белки обладают большой молекулярной массой: яичный альбумин - 36 000, гемоглобин - 152 000, миозин - 500 000. Для сравнения: молекулярная масса спирта - 46, уксусной кислоты - 60, бензола - 78.
Аминокислотный состав белков
Белки - непериодические полимеры, мономерами которых являются б-аминокислоты. Обычно в качестве мономеров белков называют 20 видов б-аминокислот, хотя в клетках и тканях их обнаружено свыше 170.
В зависимости от того, могут ли аминокислоты синтезироваться в организме человека и других животных, различают: заменимые аминокислоты - могут синтезироваться; незаменимые аминокислоты - не могут синтезироваться. Незаменимые аминокислоты должны поступать в организм вместе с пищей. Растения синтезируют все виды аминокислот.
В зависимости от аминокислотного состава, белки бывают: полноценными - содержат весь набор аминокислот; неполноценными - какие-то аминокислоты в их составе отсутствуют. Если белки состоят только из аминокислот, их называют простыми. Если белки содержат помимо аминокислот еще и неаминокислотный компонент (простетическую группу), их называют сложными.
Функции белков
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. | |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. | |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. | |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки - антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. | |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. | |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. | |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. | |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов - воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. | |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками - ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Белки можно классифицировать:
- по форме молекул (глобулярные или фибриллярные);
- по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
- по химическому строению (наличие или отсутствие небелковой части);
- по выполняемым функциям (транспортные, защитные, структурные белки и др.);
- по локализации в клетке (ядерные, цито-плазматические, лизосомальные и др.);
- по локализации в организме (белки крови, печени, сердца и др.)
14 Пировиноградная кислота (формула С3Н4O3) — α-кетопропионовая кислота. Бесцветная жидкость с запахом уксусной кислоты; растворима в воде, спирте и эфире. Используется обычно в виде солей — пируватов. Пировиноградная кислота содержится во всех тканях и органах и, являясь связующим звеном обмена углеводов, жиров и белков, играет важную роль в обмене веществ. Концентрация пировиноградной кислоты в тканях изменяется при болезнях печени, некоторых формах нефрита, раке, авитаминозах, особенно при недостатке витамина В1. Нарушение обмена пировиноградной кислоты приводит к ацетонурии (см.).
См. также Окисление биологическое.
Пировиноградная кислота (acidum pyroracemicum) — α-кетопропионовая кислота. Существует в двух таутомерных формах — кетонной и енольной: CH3COCOOH→CH2→COHCOOH. Кетоформа (см. Кетокислоты) более стабильна. Пировиноградная кислота — бесцветная жидкость, пахнущая уксусной кислотой, d154 =1,267, t°пл 13,6°, t°кип165° (при 760 мм частично разлагается). Растворима в воде, спирте и эфире. Азотной кислотой окисляется в щавелевую, а хромовым ангидридом — в уксусную кислоту. Как кетон П. к. дает гидразон, семигидразон, оксимы, а как кислота образует сложные эфиры, амиды и соли — пируваты. Используется чаще всего в виде пируватов.
П. к. получают перегонкой винной или виноградной кислот с применением водоотнимающих средств. Ее определение основано на реакциях с нитропруссидом, салициловым альдегидом, 2,4-динитрофенилгидразином, продукты которых окрашены.
Пировиноградная кислота содержится во всех тканях и органах. В крови человека в норме находится 1 мг%, а в моче 2 мг%. П. к. играет важную роль в обмене веществ, являясь связующим звеном обмена углеводов, жиров и белков. В организме П. к. образуется в результате анаэробного распада углеводов (см. Гликолиз). В дальнейшем, под действием пируватдегидрогеназы П. к. превращается в ацетил-КоА, который используется при синтезе жирных кислот, ацетилхолина, а также может передать свой ацил на щавелевоуксусную кислоту для дальнейшего окисления до CO2 и H2O (см. Окисление биологическое). П. к. также участвует в реакциях переаминирования и гликогенолиза.
Концентрация П. к. в тканях изменяется при самых различных заболеваниях: болезнях печени, некоторых формах нефрита, авитаминозах, цереброспинальных травмах, раке и т. д.
15 Вторичная структура представляет собой способ укладки полипептидной цепи в упорядоченную структуру благодаря образованию водородных связей между пептидными группами одной цепи или смежными полипептидными цепями. По конфигурации вторичные структуры делятся на спиральные (α-спираль) и слоисто-складчатые (β-структура и кросс-β-форма).
α-Спираль. Это разновидность вторичной структуры белка, имеющая вид регулярной спирали, образующейся благодаря межпептидным водородным связям в пределах одной полипептидной цепи. Модель строения α-спирали (рис. 2), учитывающая все свойства пептидной связи, была предложена Полингом и Кори. Основные особенности α-спирали:
- спиральная конфигурация полипептидной цепи, имеющая винтовую симметрию;
- образование водородных связей между пептидными группами каждого первого и четвертого аминокислотных остатков;
- регулярность витков спирали;
- равнозначность всех аминокислотных остатков в α-спирали независимо от строения их боковых радикалов;
- боковые радикалы аминокислот не участвуют в образовании α-спирали.
Внешне α-спираль похожа на слегка растянутую спираль электрической плитки. Регулярность водородных связей между первой и четвертой пептидными группами определяет и регулярность витков полипептидной цепи. Высота одного витка, или шаг α-спирали, равна 0,54 нм; в него входит 3,6 аминокислотных остатка, т. е. каждый аминокислотный остаток перемещается вдоль оси (высота одного аминокислотного остатка) на 0,15 нм (0,54:3,6 = 0,15 нм), что и позволяет говорить о равнозначности всех аминокислотных остатков в α-спирали. Период регулярности α-спирали равен 5 виткам или 18 аминокислотным остаткам; длина одного периода составляет 2,7 нм. Рис. 3. Модель а-спирали Полинга—Кори
β-Структура. Это разновидность вторичной структуры, которая имеет слабо изогнутую конфигурацию полипептидной цепи и формируется с помощью межпептидных водородных связей в пределах отдельных участков одной полипептидной цепи или смежных полипептидных цепей. Ее называют также слоисто-складчатой структурой. Имеются разновидности β-структур. Ограниченные слоистые участки, образуемые одной полипептидной цепью белка, называют кросс-β-формой (короткая β-структура). Водородные связи в кросс-β-форме образуются между пептидными группами петель полипептидной цепи. Другой тип — полная β-структура — характерен для всей полипептидной цепочки, которая имеет вытянутую форму и удерживается межпептидными водородными связями между смежными параллельными полипептидными цепями (рис. 3). Эта структура напоминает меха аккордеона. Причем возможны варианты β-структур: они могут быть образованы параллельными цепями (N-концы полипептидных цепей направлены в одну и ту же сторону) и антипараллельными (N-концы направлены в разные стороны). Боковые радикалы одного слоя помещаются между боковыми радикалами другого слоя.
В белках возможны переходы от α-структур к β-структурам и обратно вследствие перестройки водородных связей. Вместо регулярных межпептидных водородных связей вдоль цепи (благодаря им полипептидная цепь скручивается в спираль) происходит раскручивание спирализованных участков и замыкание водородных связей между вытянутыми фрагментами полипептидных цепей. Такой переход обнаружен в кератине — белке волос. При мытье волос щелочными моющими средствами легко разрушается спиральная структура β-кератина и он переходит в α-кератин (вьющиеся волосы распрямляются).
Разрушение регулярных вторичных структур белков (α-спирали и β-структур) по аналогии с плавлением кристалла называют "плавлением" полипептидов. При этом водородные связи рвутся, и полипептидные цепи принимают форму беспорядочного клубка. Следовательно, стабильность вторичных структур определяется межпептидными водородными связями. Остальные типы связей почти не принимают в этом участия, за исключением дисульфидных связей вдоль полипептидной цепи в местах расположения остатков цистеина. Короткие пептиды благодаря дисульфидным связям замыкаются в циклы. Во многих белках одновременно имеются α-спиральные участки и β-структуры. Природных белков, состоящих на 100% из α-спирали, почти не бывает (исключение составляет парамиозин — мышечный белок, на 96-100% представляющий собой α-спираль), тогда как у синтетических полипептидов 100%-ная спирализация.
Другие белки имеют неодинаковую степень спирализации. Высокая частота α-спиральных структур наблюдается у парамиозина, миоглобина, гемоглобина. Напротив, у трипсина, рибонуклеазы значительная часть полипептидной цепи укладывается в слоистые β-структуры. Белки опорных тканей: кератин (белок волос, шерсти), коллаген (белок сухожилий, кожи), фиброин (белок натурального шелка) имеют β-конфигурацию полипептидных цепей. Разная степень спирализации полипептидных цепей белков говорит о том, что, очевидно, имеются силы, частично нарушающие спирализацию или "ломающие" регулярную укладку полипептидной цепи. Причиной этого является более компактная укладка полипептидной цепи белка в определенном объеме, т. е. в третичную структуру.
16. В состав рибофлавина входит флавин- изоаллоксазиновое кольцо (азотистое основание) и спирт рибитол.
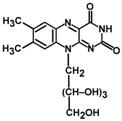
Витамин В2 (рибофлавин) играет большую роль в обмене веществ, росте и развитии организма человека; необходим для нормальной работы нервной системы; повышает активность витамина РР, усвояемость витамина В6 и пантотеновой кислоты; способствует сохранению функций органов зрения и поддержанию нормального тонуса сосудистой системы; в частности капилляров.
Витамин В2 (рибофлавин), входя в состав ряда ферментов, участвует в углеводном и белковом обмене, а также в регулировании тканевого дыхания.
Источники витамина В2
Витамин В2 содержится в мясе, фасоли, горохе. Овощи и фрукты являются дополнительными источниками поступления этого витамина в организм.
Источники витамина В2: сыр, гречневая крупа, тощее мясо, яйца (особенно желток), хлеб ржаной и из пшеничной муки грубого помола, фасоль, горох. Этот витамин имеется мясных и молочных продуктах, особенно в свежем твороге. Много этого витамина в пивных дрожжах. Витамин В2 синтезируется кишечными бактериями.
17. Распад жиров наиболее интенсивно протекает при: прорастании семян масличных растений. Эти семена содержат очень мало углеводов, и основными запасными веществами в. Жиры отличаются от углеводов или белков не только тем, что-при их окислении освобождается значительно больше энергии, но также и тем, что при окислении жиров выделяется повышенное количество воды. Если при окислении 1 г белков образуется 0 41 г воды, при окислении 1 г углеводов - - 0 55 г, то при окислении 1 г жиров-1 07 г. Это имеет большое значение для развивающегося зародыша, особенно при прорастании семян в засушливых условиях. [1]
Распад жира может происходить как в аэробных, так и анаэробных условиях. Наиболее энергичными разрушителями жира являются некоторые неспороносные палочки, например Pseu-domonas iluorescens. Многие плесени также весьма быстро гилролизуют жир. Этим свойством обладают Oidium lar. [2]
Различная интенсивность распада жиров, углеводов и белков приводит к изменению доли участия их в газообразовании, при этом доля участия жиров, как правило, снижается за счет увеличения доли участия белков, что оказывает прямое влияние на изменение состава газа и иловой жидкости. [3]
На этой стадии распада жиров в продуктах появляются не свойственные им вкус и запах, например альдегиды и кетоны сообщают жиру прогорклый вкус, кетоны вызывают специфический запах. [4]
Наибольшая масса газа образуется при распаде жиров, наименьшая - при распаде белков. Поскольку в составе активного ила преобладают белки, выход газа при его сбраживании оказывается меньшим, чем при сбраживании осадка из первичных отстойников.
18 Нуклеопротеины состоят из белков и нуклеиновых кислот. Последние рассматриваются как простетические группы. В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,– дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Названия нуклеопротеинов отражают только природу углеводного компонента (пентозы), входящего в состав нуклеиновых кислот. У РНП углевод представлен рибозой, у ДНП – дезоксирибозой. Термин «нуклеопротеины» связан с названием ядра клетки, однако ДНП и РНП содержатся и в других субклеточных структурах. Следовательно, речь идет о химически индивидуальном классе органических веществ, имеющих своеобразные состав, структуру и функции независимо от локализации в клетке. Доказано, что ДНП преимущественно локализованы в ядре, а РНП – в цитоплазме. В то же время ДНП открыты в митохондриях, а в ядрах и ядрышках обнаружены также высокомолекулярные РНП.
Пристальное внимание исследователей привлечено к структуре и функции макромолекул, включающих комплексы белков и нуклеиновых кислот. Этот особый интерес вызван тем, что многообразие проявлений жизни непосредственно связано с этими полимерными молекулами. Биохимики имеют достаточно оснований для утверждения, что природа синтезированных в клетках белков зависит в первую очередь от природы ДНП, точнее ДНК, а свойства живых организмов, как и структурная организация субклеточных органелл, клеток и целостного организма, определяются свойствами синтезированных белков.
ДНК хранит наследственную информацию. Подтверждением этого служит явление трансформации, наблюдаемое у бактерий и открытое также в культуре клеток человека. Сущность явления заключается в превращении одного генетического типа клеток в другой путем изменения природы ДНК. Так, удалось получить штамм капсулированных и вирулентных пневмококков из исходного штамма, не обладающего этими признаками, путем внесения в среду ДНК, выделенной из капсулированного (и вирулентного) штамма. С нуклеопротеинами и соответственно нуклеиновыми кислотами непосредственно связаны, кроме того, такие биологические процессы, как митоз, мейоз, эмбриональный и злокачественный рост и др.
У большинства клеток эукариот, когда ядро находится в интерфазе, из ДНК и белковых молекул образуются так называемые филаменты – нити, имеющие меняющуюся толщину (в среднем около 10 нм, реже 2 нм). Оказывается, что толщина филаментов определяется наличием или отсутствием белков, окружающих двухспиральную структуру ДНК, а длина их – молекулярной массой ДНК. Известно, что одна хромосома содержит одну молекулу ДНК, имеющую длину несколько сантиметров. Вообще ДНП входит в состав мононуклеосом, являющихся составной частью хромосомы. Таким образом, в состав хроматина входят молекула ДНК, пять различных классов белков – гистонов и так называемые негистоновые белки.
19 Третичной структурой белка называется способ укладки полипептидной цепи в пространстве. По форме третичной структуры белки делятся в основном на глобулярные и фибриллярные. Глобулярные белки чаще всего имеют эллипсовидную форму, а фибриллярные (нитевидные) белки — вытянутую (форма палочки, веретена).
Однако конфигурация третичной структуры белков еще не дает основания думать, что фибриллярные белки имеют только β-структуру, а глобулярные α-спиральные. Есть фибриллярные белки, имеющие спиральную, а не слоисто-складчатую вторичную структуру. Например, α-кератин и парамиозин (белок запирательной мышцы моллюсков), тропомиозины (белки скелетных мышц) относятся к фибриллярным белкам (имеют палочковидную форму), а вторичная структура у них — α-спираль; напротив, в глобулярных белках может быть большое количество β-структур.
Спирализация линейной полипептидной цепи уменьшает ее размеры примерно в 4 раза; а укладка в третичную структуру делает ее в десятки раз более компактной, чем исходная цепь.
Связи, стабилизирующие третичную структуру белка. В стабилизации третичной структуры играют роль связи между боковыми радикалами аминокислот. Эти связи можно разделить на:
- сильные (ковалентные)
- слабые (полярные и ван-дер-ваальсовы)
Многочисленные связи между боковыми радикалами аминокислот определяют пространственную конфигурацию белковой молекулы.
Особенности организации третичной структуры белка. Конформация третичной структуры полипептидной цепи определяется свойствами боковых радикалов входящих в нее аминокислот (которые не оказывают заметного влияния на формирование первичной и вторичной структур) и микроокружением, т. е. средой. При укладке полипептидная цепь белка стремится принять энергетически выгодную форму, характеризующуюся минимумом свободной энергии. Поэтому неполярные R-группы, "избегая" воды, образуют как бы внутреннюю часть третичной структуры белка, где расположена основная часть гидрофобных остатков полипептидной цепи. В центре белковой глобулы почти нет молекул воды. Полярные (гидрофильные) R-группы аминокислоты располагаются снаружи этого гидрофобного ядра и окружены молекулами воды. Полипептидная цепь причудливо изгибается в трехмерном пространстве. При ее изгибах нарушается вторичная спиральная конформация. "Ломается" цепь в слабых точках, где находятся пролин или гидроксипролин, поскольку эти аминокислоты более подвижны в цепи, образуя только одну водородную связь с другими пептидными группами. Другим местом изгиба является глицин, R-группа которого мала (водород). Поэтому R-группы других аминокислот при укладке стремятся занять свободное пространство в месте нахождения глицина. Ряд аминокислот - аланин, лейцин, глутамат, гистидин - способствуют сохранению устойчивых спиральных структур в белке, а такие, как метионин, валин, изолейцин, аспарагиновая кислота, благоприятствуют образованию β-структур. В молекуле белка с третичной конфигурацией встречаются участки в виде α-спиралей (спирализованные), β-структур (слоистые) и беспорядочного клубка. Только правильная пространственная укладка белка делает его активным; нарушение ее приводит к изменению свойств белка и потере биологической активности.
20. Углеводы или, как их часто называют, сахара являются первыми синтезируемыми в процессах фотосинтеза или хемосинтеза органическими веществами, а затем в процессе биохимических превращений участвуют в создании других органических веществ.
Химический состав - это углерод, водород, кислород. Пространственная структура определяется сложностью молекулы.
Классифицируются углеводы на 3 группы:
моносахариды или монозы, иногда их называют - простые сахара.
олигосахариды,
полисахариды или полиозы.
Моносахара - это простые молекулы с числом атомов углерода от 2 до 7. В соответствии с этим она называются: биозы, триозы, тетрозы, пентозы, гексозы, гептозы. Первые три - имеют линейную структуру молекул, последние - циклическую. Наиболее известный представитель моноз - глюкоза. Монозы легко растворяются в воде, легко вступают в биохимические реакции. Общая формула моноз (СН2О) п.
Олигосахара - это относительно простые молекулы, состоящие всего из 2-3 молекул моноз. Они не имеют собственной классификации, названия молекул - тривиальны. Наиболее известный представитель олигосахаридов - сахароза. Олигосахариды легко растворяются в воде, участвуют в реакциях синтеза более сложных сахаров.
Полисахариды - это биополимеры, т.е. сложные молекулы, состоящие из большого количества простых сахаров. Процесс синтеза этих молекул достаточно сложен и будет нами изучен в седьмом разделе курса. Пространственная структура полисахаридов сложна, эти молекулы нерастворимы в воде. Наиболее известные представители полисахаридов - крахмал, гликоген, клетчатка или гемицеллюлоза, пектины.
Функции углеводов:
энергетическая,
строительная,
запасающая.
21. В основе биосинтеза нуклеиновых кислот, как и биосинтеза белков, лежит матричный принцип, т.е. новая молекула строится на ранее существующей как ее отпечаток, или реплика.
В случае ДНК происходит удвоение числа молекул, и образованные молекулы являются точной копией материнских. Этот процесс носит название репликации. При репликации возникает еще одна проблема. ДНК имеет двуспиральную структуру, в которой основания уже образуют комплементарные пары, а нити как бы намотаны одна на другую. Поэтому перед началом синтеза ДНК необходимо разделить нити и сделать основания доступными для образования новых пар. Этот процесс требует довольно больших затрат энергии, поскольку структура двойной спирали ДНК поддерживается большим числом водородных связей.
Расплетание ДНК в клетке осуществляют специальные ферменты, называемые хеликазами (от лат. helix – спираль). Такой фермент движется вдоль молекулы ДНК и разделяет ее нити. Эти процессы осуществляются за счет энергии гидролиза АТФ, т.е. хеликазы являются также АТФазами. Молекулы ДНК имеют большую длину, а хеликазы, передвигаясь вдоль них, расплетают лишь небольшой участок, поэтому две нити ДНК не расходятся полностью.
Возникшие в результате однонитевые участки нестабильны. С одной стороны, они стремятся восстановить двунитевую структуру, а т.к. они комплементарны и связаны друг с другом, это может произойти легко и быстро. С другой стороны, однонитевая ДНК может легко разорваться. Поэтому образовавшиеся однонитевые участки покрываются специальным белком, связывающимся только с однонитевой ДНК, защищающим ее и мешающим ей восстановить двуспиральную структуру. Только после этого начинается синтез новой ДНК.
Его проводит фермент ДНК-полимераза. Особенность этого фермента состоит в том, что он осуществляет присоединение новых нуклеотидов к концу уже существующей цепочки в том случае, если она связана с более длинной комплементарной цепью. Но после расплетания ДНК образовались однонитевые участки, а концов, которые можно было бы удлинять, нет. Поэтому перед началом работы ДНК-полимеразы специальный фермент синтезирует короткие молекулы РНК, служащие затравками, к концам которых ДНК-полимераза присоединяет нуклеотиды.
Поскольку для образования связей между нуклеотидами нужна энергия, используются трифосфаты нуклеотидов, содержащих дезоксирибозу, т.е. дезокси-АТФ, дезокси-ГТФ, дезокси-ЦТФ и дезокси-ТТФ. Эти нуклеотиды содержат по две макроэргические связи, энергии которых с избытком хватает на образование межнуклеотидных связей и на перемещение молекулы ДНК-полимеразы вдоль нити ДНК.
То, какой нуклеотид будет присоединен, определяется матричной цепью. Против аденина в матрице фермент присоединяет тимин, против тимина – аденин, против гуанина – цитозин, а против цитозина – гуанин. В таком случае фосфат присоединяемого нуклеотида будет находиться рядом с гидроксилом предшествующего, и между ними будет образовываться связь. Если же в ферменте окажется другой, некомплементарный, нуклеотид, фосфат и гидроксил окажутся на достаточно большом расстоянии друг от друга, и связь между ними образоваться не сможет.
В результате работы ДНК-полимеразы образуется вторая нить ДНК, комплементарная матричной, т.е. образуется двуспиральная молекула, такая же, как и до начала синтеза.
Однако такой процесс может идти лишь на одной из двух матричных нитей. Так как фосфат в нуклеотидах присоединен к 5 положению дезоксирибозы, то вторую связь он должен образовывать с гидроксилом в 3 положении предыдущего нуклеотида, т.е. цепочка ДНК наращивается на 3'-конце. Это значит, что синтез начинается всегда с 5'-конца и идет в направлении к 3'-концу. В двуспиральной ДНК комплементарные нити направлены в противоположные стороны, поэтому по одной из них фермент движется в направлении от 3'-конца к 5'-концу вслед за хеликазой и синтезирует новую нить ДНК от 5'-конца к 3'-концу.
По второй матричной нити фермент должен двигаться от 5'-конца к 3'-концу и синтезировать цепочку от 3'-конца к 5'-концу, чего он делать не может. Поэтому синтез на этой нити идет в виде отдельных, относительно коротких фрагментов.
После того, как хеликаза расплела достаточно протяженный участок, непосредственно за ней образуется затравка и ДНК-полимераза начинает удлинять ее, двигаясь в направлении, противоположном движению хеликазы. Дойдя до конца однонитевого участка, она заканчивает работу и отделяется от матрицы. За это время хеликаза расплетает новый участок, в конце которого образуется новая затравка и начинается синтез нового фрагмента ДНК.
Таким образом, по одной матричной нити синтез идет непрерывно, а на второй синтезируются отдельные фрагменты. Затем специальный фермент удаляет РНК-затравки, и ДНК-полимераза застраивает образовавшиеся бреши. Однако она не может соединить между собой фрагменты, синтезированные на второй нити. Для этого в клетках есть фермент, называемый ДНК-лигаза. Она образует связь между последним нуклеотидом одного фрагмента и первым нуклеотидом следующего с использованием энергии АТФ.
После того, как синтез пройдет вдоль всей молекулы ДНК-матрицы, образуются две двуспиральные молекулы, идентичные материнской. При этом в каждой молекуле одна из нитей будет старой, входившей в состав материнской ДНК и служившей матрицей при синтезе, а вторая – вновь синтезированной. Механизм синтеза, дающий такой продукт, получил название полуконсервативного.
Важным свойством процесса синтеза ДНК является высокая точность. Обычно при репликации совершается не более одной ошибки на 1 млрд присоединенных нуклеотидов. Это значит, что у бактерий, например, один неправильный нуклеотид приходится на тысячу клеток. Понятно, что такая точность позволяет живым организмам сохранять свои генетические свойства в неограниченном ряду поколений.
Однако некоторое количество ошибок при репликации ДНК все же происходит. Кроме того, на ДНК в клетке воздействуют различные химические и физические факторы, вызывающие изменение оснований в ДНК или ее разрывы. Это должно приводить к возникновению мутаций или гибели клетки.
22 Витамин D — группа биологически активных веществ (в том числе холекальциферол и эргокальциферол). Холекальциферол синтезируется под действием ультрафиолетовых лучей в коже и поступает в организм человека с пищей. Эргокальциферол может поступать только с пищей.
Витамины группы D являются незаменимой частью пищевого рациона человека. Суточная потребность (RDA) в возрасте от 1 до 70 лет (включая беременных и кормящих матерей) составляет 15 мкг холекальциферола или 600 ME (международных единиц)[1].
Сам витамин D (холекальциферол и эргокальциферол) на самом деле является провитамином. Для активации холекальциферол сначала должен превратиться в печени в 25-гидрокси-холекальциферол (сокращенно 25(HO)D), а затем в почках — в 1,25-дигидрокси-холекальциферол (кальцитриол). При оценке адекватности обеспечения конкретного человека витамином D, наиболее полезным и универсальным лабораторным показателем является концентрация 25-гидрокси-холекальциферола в сыворотке крови[2]. Её минимальное значение, обеспечивающее оптимальное здоровье костей у большинства людей в популяции, составляет 20 нг/мл (50 нмоль/л)[1]. Однозначно установить дополнительную пользу от достижения значений выше 30 нг/мл (75 нмоль/л) в клинических исследованиях не удалось[1]. Тем не менее согласно некоторым рекомендациям, «оптимальным» считается интервал 30-60 нг/мл (75-150 нмоль/л)[3].
Растворим в жирах. Жиры также необходимы для адекватного всасывания этого витамина в кишечнике. Основным источником промышленного получения витамина D (эргостерола) служат дрожжи[4].
Дефицит витамина D — явление достаточно распространённое. В США, по данным[5] крупного популяционного исследования, проведенного в 2001—2006 годах, распространенность «риска дефицита» витамина D у взрослых и детей старше 1 года составила 8 %. К ней можно прибавить 24 % людей со статусом «риск неадекватного потребления». В сумме это почти треть населения США. В ряде других стран, с достаточным уровнем солнечного облучения, таких как Индия, Пакистан, Иран, Китай, значительная доля населения (по некоторым данным, до 60-80 %) имеют симптомы дефицита витамина D
Источники. Наибольшее количество витамина D3 содержится в продуктах животного происхождения: сливочном масле, желтке яиц, рыбьем жире.
23. Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру. К ним относятся миоглобин — белок мышечной ткани, участвующий в связывании кислорода, ряд ферментов (лизоцим, пепсин, трипсин и т. д.). Однако некоторые белки построены из нескольких полипептидных цепей, каждая из которых имеет третичную структуру. Для таких белков введено понятие четвертичной структуры, которая представляет собой организацию нескольких полипептидных цепей с третичной структурой в единую функциональную молекулу белка. Такой белок с четвертичной структурой называется олигомером, а его полипептидные цепи с третичной структурой — протомерами или субъединицами.
При четвертичном уровне организации белки сохраняют основную конфигурацию третичной структуры (глобулярную или фибриллярную). Например, гемоглобин - белок, имеющий четвертичную структуру, состоит из четырех субъединиц. Каждая из субъединиц — глобулярный белок и в целом гемоглобин тоже имеет глобулярную конфигурацию. Белки волос и шерсти - кератины, относящиеся по третичной структуре к фибриллярным белкам, имеют фибриллярную конформацию и четвертичную структуру.
24. Открытие этих веществ, которые не являются солями, белками, жирами или углеводами, но вместе с тем необходимы для полноценного питания, принадлежит американскому биохимику польского происхождения К.Функу. С 1912, когда Функ обнаружил витамины, началось интенсивное исследование их роли в метаболизме и выяснение того, почему в пищевом рационе одних организмов должны обязательно присутствовать определенные витамины, а в рационе других их может и не быть. Сейчас твердо установлено, что соединения, которые мы относим к витаминам, необходимы для нормального метаболизма всех живых существ, включая бактерии, зеленые растения и животных, однако, если некоторые организмы способны синтезировать эти соединения сами, другие должны получать их с пищей в готовом виде. Для многих витаминов в настоящее время уже выяснена их специфическая роль в метаболизме. Во всех случаях они функционируют как часть большой молекулы вещества, названного коферментом. Кофермент служит своего рода партнером фермента и субстратом для осуществления некоторых реакций. Авитаминоз, возникающий при недостаточности того или иного витамина, есть следствие нарушений в метаболизме, вызванных нехваткой кофермента.
25. Реплика́ция ДНК — процесс синтеза дочерней молекулы дезоксирибонуклеиновой кислоты на матрице родительской молекулы ДНК. В ходе последующего деления материнской клетки каждая дочерняя клетка получает по одной копии молекулы ДНК, которая является идентичной ДНК исходной материнской клетки. Этот процесс обеспечивает точную передачу генетической информации из поколения в поколение. Репликацию ДНК осуществляет сложный ферментный комплекс, состоящий из 15—20 различных белков, называемый реплисомой.
Регуляция репликации осуществляется в основном на этапе инициации. Это достаточно легко осуществимо, потому что репликация может начинаться не с любого участка ДНК, а со строго определённого, называемого сайтом инициации репликации. В геноме таких сайтов может быть как всего один, так и много. С понятием сайта инициации репликации тесно связано понятие репликон. Репликон — это участок ДНК, который содержит сайт инициации репликации и реплицируется после начала синтеза ДНК с этого сайта. Геномы бактерий, как правило, представляют собой один репликон, это значит, что репликация всего генома является следствием всего одного акта инициации репликации. Геномы эукариот (а также их отдельные хромосомы) состоят из большого числа самостоятельных репликонов, это значительно сокращает суммарное время репликации отдельной хромосомы. Молекулярные механизмы, которые контролируют количество актов инициации репликации в каждом сайте за один цикл деления клетки, называются контролем копийности. В бактериальных клетках помимо хромосомной ДНК часто содержатся плазмиды, которые представляют собой отдельные репликоны. У плазмид существуют свои механизмы контроля копийности: они могут обеспечивать синтез как всего одной копии плазмиды за клеточный цикл, так и тысяч копий
26 Основной признак живого организма -- обмен веществ и энергии. В организме непрерывно идут пластические процессы, процессы роста, образования сложных веществ, из которых состоят клетки и ткани. Параллельно происходит обратный процесс разрушения. Всякая деятельность человека связана с расходованием энергии. Даже во время сна многие органы (сердце, легкие, дыхательные мышцы) расходуют значительное количество энергии. Нормальное протекание этих процессов требует расщепления сложных органических веществ, так как они являются единственными источниками энергии для животных и человека. Такими веществами являются белки, жиры и углеводы. Большое значение для нормального обмена веществ имеют также вода, витамины и минеральные соли. Процессы образования в клетках организма необходимых ему веществ, извлечение и накопление энергии (ассимиляция) и процессы окисления и распада органических соединений, превращение энергии и ее рас ход (диссимиляция) на нужды жизнедеятельности организма между собой тесно переплетены, обеспечивают необходимую интенсивность обменных процессов в целом и баланс поступления и расхода веществ и энергии.
Обменные процессы протекают очень интенсивно. Почти половина тканей тела обновляется или заменяется полностью в течение трех месяцев. За 5 лет учебы роговица глаза у студента сменяется 350 раз, ткани желудка обновляются 500 раз, эритроцитов вырабатывается до 300 млрд. ежедневно, в течение 5--7 дней половина всего белкового азота печени заменяется.
Для регуляции основного обмена имеют существенное значение условно рефлекторные факторы. Например, у спортсменов основной обмен оказывается несколько повышенным в дни тренировочных занятий и, особенно соревнований. Вообще же спортивная тренировка, экономизируя химические процессы в организме, ведет к снижению основного обмена. Более ярко это проявляется у лиц, тренирующихся к длительной, умеренной по интенсивности, работе. Однако в ряде случаев основной обмен оказывается у спортсменов повышенным и в дни отдыха. Это объясняется длительным (в течение нескольких суток) повышением интенсивности обменных процессов в связи с выполненной напряженной работой
Основной обмен человека определяют при соблюдении следующих условий: при полном физическом и психическом покое; в положении лежа; в утренние часы; натощак, т.е. через 14ч после последнего приема пищи; при температуре комфорта (20°С). Нарушение любого из этих условий приводит к отклонению обмена веществ в сторону повышения. За 1 ч минимальные энергетические затраты организма взрослого человека составляют в среднем 1 ккал на 1 кг массы тела.
Основной обмен является индивидуальной константой и зависит от пола, возраста, массы и роста человека. У здорового человека он может держаться на постоянном уровне в течение ряда лет. В детском возрасте величина основного обмена значительно выше, чем в пожилом. Деятельное состояние вызывает заметную интенсификацию обмена веществ. Обмен веществ при этих условиях называется рабочим обменом. Если основной обмен взрослого человека равен 1700-- 1800 ккал, то рабочий обмен в 2--3 раза выше. Таким образом, основной обмен является исходным фоновым уровнем потребления энергии. Резкое изменение основного обмена может быть важным диагностическим признаком переутомления, перенапряжения и не довосстановления или заболевания.
27. Белки – амфотерные электролиты. При определенном значении pH среды число положительных и отрицательных зарядов в молекуле белка одинаково. Белки имею разнообразное строение. Есть белки нерастворимые в воде, есть белки легко раство- римые в воде. Есть белки малоактивные в химическом отношении, устойчивые к действию агентов. Есть белки крайне неустойчивые. Есть белки, имеющие вид ни-тей, достигающих в длину сотен нанометров; есть белки, имеющие форму шариков диаметром всего 5–7 нм. Они имеют большую молекулярную массу (104—107).
 2015-04-30
2015-04-30 1706
1706
