В зависимости от строения нуклеотидов различают два класса нуклеиновых кислот:
рибонуклеиновые кислоты (РНК),
дезоксирибонуклеиновые кислоты (ДНК).
В РНК входят нуклеотиды А, Г, У и Ц, в состав которых входит рибоза, а в ДНК входят нуклеотиды А, Г, Т и Ц, в состав которых входит дезоксирибоза.
Функции нуклеиновых кислот разнообразны.
ДНК является основным носителем наследственной информации, находится в ядрах клеток, и, реже - в митохондриях и пластидах, определяя так называемую материнскую (цитоплазматическую) наследственность.
РНК выполняет в клетке различные функции и в зависимости от них разделяется на:
информационную (или матричную),
транспортную,
рибосомальную.
В комплексе с белками нуклеиновые кислоты образуют сложные биологические молекулы - нуклеопротеиды, например, нуклеопротеиды семян растений.
30 При апотомическом распаде глюкозо-6-фосфата не происходит его превращения в фруктозо-1,б-дифос-фат в результате введения в молекулу второй фосфатной группы. Распад глюкозо-б-фосфата в этом случае начинается реакцией окисления его в 6-фосфоглюконолактон. Окисление состоит в отнятии двух атомов водорода от 1-го углеродного атома глюкозо-6-фосфата. Акцептором Н служит НАДФ+, являющийся коферментом глюкозо-6-фосфатдегидрогеназы, ускоряющей эту реакцию:
Глюкоэо-6- Никотянаынд- 6-фосфо- Никотииаыид-
фосфат ад ннндниуклео- глюкоио- аденнндинук-
тидфосфат окис- 8-лактон леотидфосфат
ленный (НАДФ+) восстановленный
(НАДФН+Н+)
Апотомический распад можно разделить на две фазы: окислительную и анаэробную. Рассмотрим отдельные реакции этого метаболического пути.
Окислительная фаза апотомического распада глюкозы. Как и в гликолизе первой стадией является фосфорилирование глюкозы с образованием глюкозо-6-фосфата. Далее глюкозо-6-фосфат дегидрируется с участием глюкозо-6-фосфатдегидрогеназы, коферментом которой служит НАДФ. Образующийся 6-фосфоглюконолактон спонтанно или с участием лактоназы гидролизуется с образованием 6-фосфоглюконовой кислоты. Заключительным процессом окислительной ветви пентозофосфатного цикла является окисление 6-фосфоглюконовой кислоты соответствующей дегидрогеназой. Одновременно с процессом дегидрирования происходит декарбоксилирование 6-фосфоглюконовой кислоты. С потерей одного углеродного атома глюкоза превращается в пентозу.
31. Под первичной структурой нуклеиновых кислот понимают порядок, последовательность расположения мононуклеотидов в полинуклеотидной цепи ДНК и РНК. Такая цепь стабилизируется 3',5'-фосфодиэфирными связями. Поскольку молекулярная масса нуклеиновых кислот колеблется в широких пределах (от 2•104 до 1010–1011), установить первичную структуру всех известных РНК и особенно ДНК весьма сложно. Тем не менее во всех нуклеиновых кислотах (точнее, в одноцепочечной нуклеиновой кислоте) имеется один и тот же тип связи – 3',5'-фосфодиэфирная связь между соседними нуклеотидами. Эту общую основу структуры можно представить следующим образом:
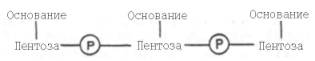
Установлено, что в образовании межнуклеотидной связи участвуют гидроксильные группы в 3'- и 5'-положениях остатков углевода.
К настоящему времени удалось определить первичную структуру почти всех тРНК, ряда молекул 5S рРНК, 16S рРНК E.coli, вирусных РНК, в состав которых входят сотни и тысячи нуклеотидных остатков. Ниже приводится примерная схема последовательности нуклеотидов в молекуле РНК. Все клеточные РНК в основном состоят из одноцепочечной по-линуклеотидной цепи. Полинуклеотидная цепь молекулы РНК имеет на одном конце почти всегда свободный монофосфорный эфир, который принято обозначать как 5'-конец; на противоположном конце цепи такой фосфат отсутствует, а содержится нуклеотид со свободными 2'- и 3'-гидроксильными группами. Если подвергнуть щелочному гидролизу молекулу РНК, то в качестве концевого нуклеотида будут обнаружены ЦМФ со свободным фосфатом у 5'-конца и свободный аденозин в виде свободного нуклеозида у 3'-конца полинуклеотидной цепи.
В выяснении первичной структуры РНК решающую роль сыграли методы ступенчатого гидролиза, осуществленного в основном экзонуклеа-зами и заключающегося в последовательном отщеплении по одному мононуклеотиду с одного конца молекулы нуклеиновой кислоты.
32 Пантотеновая кислота входит в состав ферментов, которые играют очень важную роль в обмене веществ — расщепляют углеводы, белки и жиры для получения энергии. Этот витамин участвует в выработке эритроцитов, гормонов коры надпочечников, холестерина, витамина D, нейротрансмиттеров — веществ, участвующих в передаче нервных импульсов.
Исследования показали, что употребление пантотеновой кислоты может снизить содержание холестерина в крови на 15 % и уменьшить количество жиров на 20-30 %. Ученые и врачи полагают что именно этот витамин помогает поддерживать тело в атлетической форме.
Пантотеновая кислота регулирует функции нервной системы и двигательную функцию кишечника. Очень часто этот витамин используют для лечения ряда кожных заболеваний. Следует отметить, что во многих зарубежных лекарственных справочниках, в медицинской и фармакологической литературе, на этикетках витаминных препаратов и пищевых добавок этот витамин обозначают В5, что не соответствует принятой в России классификации витаминов.
Значение пантотеновой кислоты определяется исключительно важной ролью ее коферментных форм в ключевых реакциях метаболизма, а также способностью производных витамина, таких как, S-сульфопантетеин, поддерживать рост бифидобактерий - важного компонента биоценоза кишечника.
) фосфопантетеин - активной субъединицей АПБ (ацил-переносящего белка) синтазы ЖК
) дефосфо-КоА - кофермент цитратлиазы и N-ацетилтрансферазы.
) КоА-SH - главный кофермент клетки, с участием которого протекают многочисленные реакции метаболизма:
·Активирование ацетата (СН3-СО~S-KoA). Ацетил-КоА - субстратом для синтеза жирных кислот, холестерина и стероидных гормонов, ацетоновых тел, ацетилхолина, ацетилглюкозаминов. С него начинаются реакции главного метаболического пути клетки - цикла Кребса. Ацетил-КоА принимает участие в реакциях обезвреживания (ацетилирование биогенных аминов и чужеродных соединений).
·Активирование жирных кислот (образование ацил-КоА). Ацил-КоА используется для синтеза липидов, окисляясь, он служит также источником энергии.
·Транспорт жирных кислот в митохондрии.
·Окислительное декарбоксилирование кетокислот - пировиноградной (при этом образуется ацетил-КоА) и?-кетоглутаровой (при этом образуется сукцинил-КоА, используемый в реакциях синтеза гема гемоглобина и простетической группы цитохромов).
Пищевые источники: широко распространен в продуктах растительного и животного происхождения, особенно в пчелином маточном молочке и пивных дрожжах, в печени животных, яичном желтке, гречихе, овсе, бобовых.
33 Синтез жиров осуществляется главным образом из углеводов, поступивших в избыточном количестве и не используемых для пополнения запаса гликогена. Кроме того, в синтезе участвуют и некоторые аминокислоты. Накоплению жиров способствует и избыток пищи.
Строительным блоком для синтеза жирных кислот в цитозоле клетки служит ацетил-КоА, который в основном поступает из митохондрий. Ацетил Ко-А самостоятельно не может диффундировать в цитозоль клетки, так как митохондриальная мембрана непроницаема для него. Вначале внутримитохондриальный ацетил-КоА взаимодействует с оксалоацетатом, в результате чего образуется цитрат. Реакция катализируется ферментом цитрат-синтазой. Образовавшийся цитрат переносится через мембрану митохондрий в цитозоль при помощи специальной трикарбоксилаттранспортирующей системы.
В цитозоле цитрат реагирует с НS-КоА и АТФ, вновь распадаясь на ацетил-КоА и оксалоацетат. Эта реакция катализируется АТФ-цитрат-лиазой. Уже в цитозоле оксалоацетат при участии цитозольной малатдегидрогеназы восстанавливается до малата. Последний при помощи дикарбоксилаттранспортирующей системы возвращается в митохондриальный матрикс, где окисляется до оксалоацетата.
35 ФЕРМЕНТЫ -органические вещества белковой природы, которые синтезируются в клетках и во много раз ускоряют протекающие в них реакции, не подвергаясь при этом химическим превращениям. По строению ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные). Простой фермент состоит только из белковой части; в состав сложного фермента входит белковая и небелковая составляющие. Иначе сложный фермент называют холоферментом. Белковую часть в его составе называют апоферментом, а небелковую — коферментом. Химическая природа коферментов была выяснена в 30-е гг. Оказалось, что роль некоторых коферментов играют витамины или вещества, построенные с участием витаминов В1, В2, В5, В6, В12, Н, Q и др. Особенностью сложных ферментов является то, что отдельно апофермент и кофермент не обладают каталитической активностью.
В составе как простого, так и сложного фермента, выделяют субстратный, аллостерический и каталитический центры.
Каталитический центр простого фермента представляет собой уникальное сочетание нескольких аминокислотных остатков, расположенных на разных участках полипептидной цепи. Образование каталитического центра происходит одновременно с формированием третичной структуры белковой молекулы фермента. Чаще всего в состав каталитического центра простого фермента входят остатки серина, цистеина, тирозина, гистидина, аргинина, аспа-рагиновой и глутаминовой кислот.
Субстратный центр простого фермента — это участок белковой молекулы фермента, который отвечает за связывание субстрата. Субстратный центр образно называют «якорной площадкой», где субстрат прикрепляется к ферменту за счет различных взаимодействий между определенными боковыми радикалами аминокислотных остатков и соответствующими группами молекулы субстрата. Субстрат с ферментом связывается посредством ионных взаимодействий, водородных связей; иногда субстрат и фермент связываются ковалентно. Гидрофобные взаимодействия также играют определенную роль при связывании субстрата с ферментом. В простых ферментах субстратный центр может совпадать с каталитическим; тогда говорят об активном центре фермента. Так, активный центр амилазы — фермента, гидролизующего -1,4-гликозидные связи в молекуле крахмала — представлен остаткамиa гистидина, аспарагиновой кислоты и тирозина.
Аллостерический центр представляет собой участок молекулы фермента, в результате присоединения к которому какого-то низкомолекулярного вещества изменяется третичная структура белковой молекулы фермента, что влечет за собой изменение его активности. Аллостерический центр является регуляторным центром фермента.
36 Основными метаболическими процессами являются анаболизм (ассимиляция) и катаболизм (диссимиляция).
Анаболизм, или ассимиляция (от лат. assimilatio — уподобление), представляет собой эндотермический процесс уподобления поступающих в клетку веществ веществам самой клетки. Она является «созидательным» метаболизмом.
Важнейшим моментом ассимиляции является синтез белков и нуклеиновых кислот. Частным случаем анаболизма является фотосинтез, который представляет собой биологический процесс, при котором органическое вещество синтезируется из воды, двуокиси углерода и неорганических солей под влиянием лучистой энергии Солнца. Фотосинтез в зеленых растениях является автотрофным типом обмена.
Катаболизм, или диссимиляция (от лат. dissimilis — расподобление), является экзотермическим процессом, при котором происходит распад веществ с освобождением энергии. Этот распад происходит в результате переваривания и дыхания. Переваривание представляет собой процесс распада крупных молекул на более мелкие молекулы, тогда как дыхание является процессом окислительного катаболизма простых Сахаров, глицерина, жирных кислот и дезаминированных аминокислот, в результате которого происходит освобождение жизненно необходимой химической энергии. Эта энергия используется для пополнения запасов аденозинтри-фосфата (АТФ), который является непосредственным донором (источником) клеточной энергии, универсальной энергетической «валютой» в биологических системах. Пополнение запасов АТФ обеспечивается реакцией фосфата (Ф) с аденозиндифосфатом (АДФ), а именно:
АДФ + Ф + энергия ® АТФ
Когда АТФ разлагается на АДФ и фосфат, энергия клетки освобождается и используется для работы в клетке. АТФ представляет собой нуклеотид, состоящий из остатков аденина, рибозы и трифосфата (трифосфатных групп), тогда как аденозиндифосфат (АДФ) имеет лишь две фосфатные группы. Богатство АТФ энергией определяется тем, что его трифосфатный компонент содержит две фос-фоангидридные связи. Энергия АТФ превышает энергию АДФ на 7000 ккал/моль. Этой энергией обеспечиваются все биосинтетические реакции в клетке в результате гидролиза АТФ до АДФ и неорганического фосфата. Итак, цикл АТФ-АДФ является основным механизмом обмена энергии в живых системах.
К живым системам применимы два закона термодинамики.
В соответствии с первым законом термодинамики (законом сохранения энергии) энергия на протяжении химических и физических процессов не создается, не исчезает, а просто переходит из одной формы в другую, пригодную в той или иной мере для выполнения работы, т. е. использование энергии для выполнения какой-либо работы или переход энергии из одной формы в другую не сопровождается изменением (уменьшением или увеличением) общего количества энергии. Имея в виду глобальные категории, можно сказать, что вопреки любым физическим или химическим изменениям во Вселенной, количество энергии в ней останется неизменным.
В соответствии со вторым законом термодинамики физические и химические процессы протекают в направлении необратимого перехода полезной энергии в хаотическую, неупорядоченную форму и установления равновесия между упорядоченным состоянием и хаотическим, неупорядоченным. По мере приближения к установлению равновесия между упорядоченностью и неупорядоченностью и к остановке процесса происходит уменьшение свободной энергии, т.е. той порции общей (полезной) энергии, которая способна производить работу при постоянной температуре и постоянном давлении. Когда количество свободной энергии уменьшается, то повышается та часть общей внутренней энергии системы, которая является мерой степени случайности и неупорядоченности (дезорганизации) и называется энтропией. Другими словами, энтропия есть мера необратимого перехода полезной энергии в неупорядоченную форму. Таким образом, естественная тенденция любой системы направлена на повышение энтропии и уменьшение свободной энергии, которая является самой полезной термодинамической функцией. Живые организмы являются высокоупорядоченными системами. Для них характерно содержание очень большого количества информации, но они бедны энтропией.
Если Вселенная представляет собой реакционные системы, под которыми понимают совокупность веществ, благодаря которым протекают физические и химические процессы, с одной стороны, и окружающую среду, с которой реакционные системы обмениваются информацией, с другой стороны, то в соответствии со вторым законом термодинамики в ходе физических процессов или химических реакций энтропия Вселенной увеличивается. Метаболизм живых организмов не сопровождается возрастанием внутренней неупорядоченности, т. е. для живых организмов не характерны возрастные энтропии. В любых условиях все организмы, начиная от бактерий и заканчивая млекопитающими, сохраняют упорядоченный характер своего строения. Однако для самой энтропии характерно то, что она возрастает в окружающей среде, причем непрерывное возрастание энтропии в окружающей среде обеспечивается существующими в среде живыми организмами. Например, для извлечения свободной энергии анаэробные организмы используют глюкозу, которую они получают из окружающей среды и окисляют молекулярным кислородом, проникающим тоже из среды. При этом конечные продукты окислительного метаболизма (СО2 и H2O) поступают в среду, что и сопровождается возрастанием энтропии среды, которое частично происходит из-за рассеивания тепла. Возрастание энтропии в этом случае повышается, кроме того за счет возрастания количества молекул после окисления (C6H12O6 + 6O2 ® 6СО2 + 6Н2О), т. е. образование из 7 молекул 12 молекул. Как видно, молекулярная неупорядоченность ведет к энтропии.
Для живых существ первичным источником энергии является солнечная радиация, в частности видимый свет, который состоит из электромагнитных волн, встречающихся в виде дискретных единиц, называемых фотонами или квантами света. В живом мире одни живые существа способны улавливать световую энергию, другие получают энергию в результате окисления пищевых веществ.
Энергия видимого света улавливается зелеными растениями в процессе фотосинтеза, который осуществляется в хлоропластах их клеток. Благодаря фотосинтезу живые существа создают упорядоченность из неупорядоченности, а световая энергия превращается в химическую энергию, запасаемую в углеводах, являющихся продуктами фотосинтеза. Таким образом, фотосинтезирующие организмы извлекают свободную энергию из солнечного света. В результате этого клетки зеленых растении обладают высоким содержанием свободной энергии.
Получение энергии в результате окисления неорганических веществ происходит при хемосинтезе.
Животные организмы получают энергию, уже запасенную в углеводах, через пищу. Следовательно, они способствуют увеличению энтропии среды. В митохондриях клеток этих организмов энергия, запасенная в углеводах, переводится в форму свободной энергии, подходящей для синтеза молекул других веществ, а также для обеспечения механической, электрической и осмотической работы клеток. Освобождение энергии, запасенной в углеводах, осуществляется в результате дыхания — аэробного и анаэробного. При аэробном дыхании расщепление молекул, содержащих запасенную энергию, происходит путем гликолиза и в цикле Кребса. При анаэробном дыхании действует только гликолиз. Таким образом, жизнедеятельность клеток животных организмов обеспечивается в основном энергией, источником которой служат реакции окисления-восстановления «топлива» (глюкозы и жирных кислот), в процессе которых происходит перенос электронов от одного соединения (окисление) к другому (восстановление). С окислительно-восстановительными реакциями сопряжено фосфорилирование. Эти реакции протекают как при фотосинтезе, так и дыхании.
37олимерные молекулы нуклеиновых кислот расщепляются в тканях преимущественно гидролитическим путем при участии специфических ферментов, относящихся к нуклеазам. Различают эндонуклеазы, разрывающие внутренние межнуклеотидные связи в молекулах ДНК и РНК, вызывающие деполимеризацию нуклеиновых кислот с образованием олигонуклеотидов, и экзонуклеазы, катализирующие гидролитическое отщепление концевых мононуклеотидов от ДНК и РНК или олигонуклеотидов. Помимо гидролитических нуклеаз, имеются ферменты, катализирующие распад нуклеиновых кислот, например, посредством трансферазной реакции. Они катализируют перенос остатка фосфорной кислоты от 5'-го углеродного атома рибозы одного мононуклеотида ко 2'-му углеродному атому соседнего мононуклеотида, сопровождающийся разрывом межнуклеотидной связи и образованием фосфодиэфирной связи между 2'-м и 3'-м углеродными атомами рибозы одного и того же мононуклеотида. К настоящему времени открыты группы нуклеаз, катализирующие распад ДНК и РНК.
Дезоксирибонуклеазы I катализируют разрыв внутренних фосфодиэфир-ных связей в одной из двух цепей молекулы ДНК между 3'-м углеродным атомом дезоксирибозы и остатком фосфата с образованием низкомолекулярных олигодезоксирибонуклеотидов:
ДНК + (n–1) Н2O –> n-Олигодезоксирибонуклеотиды.
Среди продуктов реакции открыты также моно- и динуклеотиды. Типичными представителями этих ферментов являются ДНКазы поджелудочной железы. Одна из них (ДНКаза I) была получена в чистом виде, расшифрована последовательность всех ее 257 аминокислотных остатков. Фермент наиболее активен при рН 6,8–8,0, активируется двухвалентными ионами Mg2+и Мn2+ и ингибируется конечными продуктами ферментативной реакции – олигонуклеотидами.
Дезоксирибонуклеазы II вызывают деполимеризацию молекулы ДНК в результате парных разрывов фосфодиэфирных связей обеих цепей ДНК с образованием более крупных олигодезоксирибонуклеотидов. Представителем их является ДНКаза II, выделенная из селезенки, имеющая мол. массу 38000 и состоящая из 343 аминокислотных остатков. В составе этой ДНКазы открыт глюкозамин. Фермент также активируется ионами металлов, ингибируется анионами; его оптимум рН между 5,5 и 5,8.
Помимо этих ферментов, открыты (преимущественно у микроорганизмов) еще экзодезоксирибонуклеазы, гидролизующие фосфодиэфирные связи молекулы ДНК с отщеплением концевых 5'-дезоксирибонуклеотидов. Например, из E. coli выделено четыре таких фермента, обозначаемых экзодезоксирибонуклеазами I, II, III и IV.
Рестриктазы – ферменты ДНКазного типа действия – катализируют распад чужеродной (в основном фаговой) ДНК в строго определенных участках молекулы, имеющих структуру палиндромов. Из E. coli выделены и охарактеризованы две такие рестриктазы, обозначаемые EcoRI и EcoRII соответственно. Рестриктазы оказывают строго специфическое действие, поэтому они используются для расшифровки последовательности нуклео-тидных остатков в ДНК фагов и вирусов. Кроме того, это уникальное свойство рестриктаз находит все большее практическое применение в генетической инженерии при «вырезании» определенных фрагментов ДНК и «встраивании» их в геном бактериальной ДНК (получение рекомби-нантных ДНК). В результате клетке передается ряд не свойственных ей прежде наследственных признаков. Теоретическое и главным образом практическое значение подобных исследований трудно переоценить. Свидетельством огромного интереса к проблемам генетической инженерии является создание и успешное выполнение в институтах Российской АН и лабораторий ряда стран совместной комплексной программы – проекта «Рестриктазы».
Многие сотни рестриктаз выделены в очищенном состоянии и уже являются коммерческими препаратами.
Из ферментов, катализирующих гидролитический распад РНК, наиболее изучены рибонуклеазы I. Они гидролизуют фосфодиэфирные связи внутри молекулы РНК. Выделенная из поджелудочной железы многих животных РНКаза состоит из 124 аминокислотных остатков во всех случаях, хотя ферменты несколько различаются последовательностью аминокислотных остатков; выяснена также третичная структура ряда РНКаз (см. главу 4). Получен в гомогенном состоянии из плесневого гриба рода Aspergillus фермент гуанилрибонуклеаза, катализирующая эндонуклеолитическое расщепление РНК.
Из ферментов, осуществляющих распад ДНК и РНК не по гидролитическому пути, следует назвать полинуклеотид-фосфорилазу и группу ДНК-гликозидаз. В настоящее время подробно изучены физико-химические свойства и биологическая роль микробной полинуклеотид-фосфорилазы в лаборатории С.С. Дебова; в той же лаборатории фермент открыт в животных тканях.
Механизм действия фермента сводится к переносу нуклеотидных остатков с РНК на неорганический фосфат, при этом образуется рибо-нуклеотиддифосфат (РДФ):
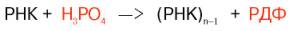
Предполагают, что in vivo фермент катализирует распад клеточных РНК, преимущественно мРНК, до нуклеозиддифосфатов, участвуя тем самым в регуляции концентрации клеточного неорганического фосфата. Следует указать еще на одну не менее важную уникальную функцию полинуклеотид-фосфорилазы – способность фермента катализировать в опытах in vitro синтез из свободных нуклеозиддифосфатов (НДФ) поли-рибонуклеотидов с заданной последовательностью. Этот фермент сыграл выдающуюся роль в расшифровке кода белкового синтеза в лабораториях лауреатов Нобелевской премии С. Очоа и М. Ниренберга (см. главу 15).
Открыта группа ДНК-гликозидаз, участвующих в реакциях отщепления модифицированных пуриновых и пиримидиновых оснований (например, урацила, образующегося при дезаминировании остатка цитозина в одной из цепей ДНК).
Таким образом, ДНК-гликозидазы выполняют важную функцию в процессах репарации (восстановление структуры) молекулы ДНК.
В результате последовательного действия разнообразных клеточных экзо- и эндонуклеаз нуклеиновые кислоты подвергаются распаду до стадии рибо- и дезоксирибонуклеозид-3'- и 5'-фосфатов. Дальнейший распад образовавшихся продуктов связан с ферментативными превращениями моно-нуклеотидов, нуклеозидов и далее свободных азотистых оснований. На I этапе гидролиза действуют 3'- и 5'-нуклеотидазы, катализирующие гидролитический распад мононуклеотидов до свободных нуклеозидов с отщеплением неорганического фосфата соответственно от С-3' или С-5' атомов углеводного остатка. На II этапе происходит перенос остатка рибозы от нуклеозида на свободную фосфорную кислоту с образованием рибозо-1-фосфата и свободного азотистого основания.
38 Витамин В1 (тиамин) состоит из пиримидинового и тиазольного колец, соединенных метиленовым мостиком (рис. 79.1), и синтезируется многими растениями и микроорганизмами. Большинство животных должны получать этот витамин с пищей. Однако у крыс и голубей его отсутствие в рационе не приводит к авитаминозу, если с пищей поступает много соединений, содержащих пиримидиновое и тиазольное кольца. По-видимому, у них в организме происходит, хотя и медленно, образование витамина В1 из двух частей молекулы. Небольшое количество этого витамина синтезируется также микрофлорой кишечника. Всасывание происходит путем активного и пассивного транспорта со скоростью до 5 мг/сут.
Общее содержание витамина В, в организме составляет примерно 25-30 мг: 80% - в виде дифосфата (пирофосфата), 10% - в виде трифосфата, 10% - в виде монофосфата.
Большое количество витамина В1 содержится в скелетных мышцах, сердце, печени, почках и головном мозге.
Источники. Витамин В1 - первый витамин, выделенный в кристаллическом виде К. Функом в 1912 г. Он широко распространён в продуктах растительного происхождения (оболочка семян хлебных злаков и риса, горох, фасоль, соя и др.). В организмах животных витамин В1, содержится преимущественно в виде дифосфорного эфира тиамина (ТДФ); он образуется в печени, почках, мозге, сердечной мышце путём фосфорилирования тиамина при участии тиаминкиназы иАТФ.
Основной, наиболее характерный и специфический признак недостаточности витамина В1 - полиневрит, в основе которого лежат дегенеративные изменения нервов. Вначале развивается болезненность вдоль нервных стволов, затем - потеря кожной чувствительности и наступает паралич (бери-бери). Второй важнейший признак заболевания - нарушение сердечной деятельности, что выражается в нарушении сердечного ритма, увеличении размеров сердца и в появлении болей в области сердца. К характерным признакам заболевания, связанного с недостаточностью витамина В1 относят также нарушения секреторной и моторной функций ЖКТ; наблюдают снижение кислотности желудочного сока, потерю аппетита, атонию кишечника.
39. Транскрипция — синтез РНК с использованием ДНК в качестве матрицы. В результате возникает 3 типа РНК:
- матричная (мРНК);
- рибосомная (рРНК);
- транспортная (тРНК).
Процесс транскрипции требует больших затрат энергии в виде АТФ и осуществляется ферментом ДНК-зави-симой-РНК-полимеразой трех типов и рядом так называемых вспомогательных факторов. Одномоментно транскрибируется не вся молекула ДНК, а лишь отдельные ее отрезки. Они называются единицами транскрипции, или транскриптонами. По сути транскриптон — это и есть ген с точки зрения молекулярной биологии. Напомним, что промотор — участок ДНК длиной в несколько десятков нуклеотидов, куда присоединяется РНК-полимераза и откуда начинается транскрипция. Терминатор — участок ДНК, содержащий сигнал (последовательность) окончания транскрипции. Поскольку у бактерий оперонная организация генома, у них транскрибируются сразу несколько генов, объединенных одной функцией. У эукариот за один раз транскрибируется только один ген. Транскрипция, как и репликация ДНК, основана на способности азотистых оснований нуклеотидов к комплементарному связыванию. Аналогично репликации, при транскрипции полимераза (здесь уже РНК-полимераза) шаг за шагом подбирает и “сшивает” нуклеотиды комплементарные матричной последовательности. Отличительной особенностью транскрипции является то, что в РНК нет тимидина, его замещает уридин; соответственно при транскрипции аденозин молекулы ДНК спаривается с уридином синтезируемой РНК. На время транскрипции двойная цепь ДНК разрывается и синтез РНК осуществляется по одной цепи ДНК, которая называется кодирующей. Вторая цепь является некодирующей. Какая цепь будет кодирующей, определяется тем, на какой из них находится промотор. В процессе транскрипции образуется гибрид одноцепочечной ДНК с РНК, который существует короткое время и очень быстро распадается, при этом восстанавливается нативная двуцепочечность ДНК.
Цикл транскрипции состоит из трех стадий:
- инициации;
- элонгации;
- терминации.
Им предшествует узнавание промотора или подготовительная стадия, на которой РНК-полимераза узнает промотор и связывается с ним. Одновременно происходит локальное расплетение ДНК примерно на 10 пар нуклеотидов.
1 Инициация. На этой стадии происходит образование нескольких начальных звеньев РНК (так называемый синтез критической длины). До этого комплекс полимераза-ДНК не стабилен и способен распадаться.
2. Элонгация. Продолжается дальнейшее расплетение ДНК и синтез РНК по кодирующей цепи. Он, равно как и синтез ДНК, осуществляется в направлении 5- 3.
3. Терминация. Как только полимераза достигает терминатора, она немедленно отщепляется от ДНК, локальный гибрид ДНК-РНК разрушается и новосинтезированная РНК транспортируется из ядра в цитоплазму. На этом транскрипция заканчивается.
Созревание РНК
Все образовавшиеся РНК непосредственно после трансляции не способны, функционировать, так как они синтезируются в виде молекул-предшественников: пре-р, пре-т и пре-м РНК. Чтобы начать работать, пре-РНК должны подвергнуться процессингу (созреванию). Под процессингом понимают совокупность биохимических реакций, при которых пре-РНК укорачиваются, подвергаются химическим модификациям, в результате которых образуются зрелые РНК. Процессинг т- и рРНК осуществляется по одинаковому плану. В основном вырезаются лишние фрагменты с 3'- и 5'-концов и химически модифицируются азотистые основания.
Процессинг мРНК гораздо сложнее. Интересно, что мРНК прокариот (бактерий) процессингу не подвергаются вообще — это единственные РНК, способные работать сразу после синтеза. У эукариот Процессинг мРНК осуществляется многоступенчато и включает модификацию 3'- и 5'- концов, а также вырезание интронов. В последнем процессе участвует четвертый известный тип РНК — малая ядерная РНК (мяРНК). которая удерживает концы, экзонов при вырезании интронов.
40 Ферменты широко используются в различных сферах человеческой деятельности. Во-первых, они являются практически незаменимым инструментом во многих областях биологических исследований – генной инженерии, биотехнологии, молекулярной биологии, биохимии и других. Ферменты используются в пищевой промышленности, например, для осветления фруктовых соков (целлюлазы, пектиназы), для получения детского питания (трипсин), в пивоварении, сыроделии. Ферменты используются во многих чистящих и моющих средствах (протеазы, амилазы, липазы). В фармакологии ферменты используются для получения различных лекарств. Кроме того, ферменты могут использоваться в качестве специфических маркеров при диагностике различных заболеваний человека или в качестве индикаторов, позволяющих детектировать следовые количества исследуемых веществ.
41 Наиболее распространённой формой вторичной структуры ДНК является двойная спираль. Эта структура образуется из двух взаимно комплементарных антипараллельных полидезоксирибонуклеотидных цепей, закрученных относительно друг друга и общей оси в правую спираль[5]. При этом азотистые основания обращены внутрь двойной спирали, а сахарофосфатный остов — наружу. Впервые эту структуру описали Джеймс Уотсон и Френсис Крик в 1953 году[6].
В формировании вторичной структуры ДНК участвуют следующие типы взаимодействий:
- водородные связи между комплементарными основаниями (две между аденином и тимином, три — между гуанином и цитозином);
- стэкинг-взаимодействия;
- электростатические взаимодействия;
- Ван-дер-Ваальсовы взаимодействия.
В зависимости от внешних условий параметры двойной спирали ДНК могут меняться, причём иногда существенно. Правоспиральные ДНК со случайной нуклеотидной последовательностью можно грубо разделить на два семейства — А и В, главное отличие между которыми — конформация дезоксирибозы
Молекулы РНК представляют собой единичные полинуклеотидные цепи. Отдельные участки молекулы РНК могут соединяться и образовывать двойные спирали[5]. По своей структуре спирали РНК похожи на А-форму ДНК. Однако часто спаривание оснований в таких спиралях бывает неполным, а иногда даже и не уотсон-криковским[9]. В результате внутримолекулярного спаривания оснований формируются такие вторичные структуры, как стебель-петля («шпилька») и псевдоузел[10].
Вторичные структуры в мРНК служат для регуляции трансляции. Например, вставка в белки необычных аминокислот, селенометионина и пирролизина, зависит от «шпильки», расположенной в 3' нетранслируемой области. Псевдоузлы служат для программированного сдвига рамки считывания при трансляции.
42. Номенклатура и классификация ферментов
Сначала ферментам давали произвольные названия – пепсин, трипсин и т.п. когда количество ферментов возросло возникла необходимость классифицировать эти вещества. В 1896 году Дюкло предложил называть ферменты по субстрату, на который они действуют с прибавлением окончания –аза., например, сахараза и т.п. в последующем было отмечено, что ферменты могут действовать на одно вещество, но ускорять разные реакции. Поэтому в 1961 году на Международном Биохимическом съезде была принята классификация ферментов, которая используется по настоящее время. Несмотря на многочисленность ферментов, все реакции, ускоряемые ими можно разделить на 6 типов. В связи с этим различают 6 классов ферментов:
Оксидоредуктазы – ускоряют ОВР;
Трансферазы – ускоряют перенос различных групп атомов с одного вещества на другое;
Гидролазы – ускоряют расщепление сложных веществ до простых с участием воды (т.е. путем гидролиза);
Лиазы – ускоряют реакции распада веществ без участия воды или способствуют присоединению групп атомов по месту разрыва двойных связей;
Изомеразы – ведут реакции изомеризации;
Лигазы, или синтетазы – ускоряют синтез веществ за счет соединения молекул между собой.
Номенклатура ферментов. Каждый класс делится на подкласс, подкласс делится на подподкласс, в каждом подподклассе обозначен порядковый номер представителя. Поэтому для каждого фермента существует шифр, состоящий из 4 цифр – первая показывает номер класса, вторая – номер подкласса, третья – номер подподкласса, четвертая – место фермента в подподклассе. Например, шифр для липазы поджелудочной железы – 3.1.1.3., это означает, что липаза п/ж относится к гидролазам, (третий класс, т.е. ускоряет гидролиз), к первому подклассу – эстеразам (т.е. ускоряет гидролиз сложно-эфирных связей), к первому подподклассу (т.е. ускоряет гидролиз сложно-эфирных связей, образованных карбоновыми кислотами), место в подподклассе – третье.
Гидролазы — ферменты, широко распространенные в природе, встречаются в клетках и пищеварительных соках. Почти все гидролазы ЖКТ однокомпонентные ферменты. В клетках гидролазы находятся в особых органеллах – лизосомах и потому называются лизосомальными ферментами. Лизосомальные ферменты выполняют защитную роль: под их влиянием чужеродные вещества, поступившие в клетку, а затем в лизосомы, подвергаются расщеплению. Расщепляются также вещества, неиспользованные организмом, поэтому лизосомальные ферменты называют клеточными санитарами. При инфекционных заболеваниях, при воспалительных процессах, уменьшении рН, гипоксии мембраны лизосом становятся проницаемыми и гидролазы могут выходить из них, начиная переваривать собственную клетку, вызывая аутолиз клетки. Поэтому лизосомы называют клеточными самоубийцами.
Классификация гидролаз Класс гидролаз включает ферменты, ускоряющие гидролитические реакции сложных эфиров (3.1), гликозидов (3.2), простых эфиров (3.3), пептидов (3.4), других С-N связей (3.5), ангидридов кислот (3.6).
 2015-04-30
2015-04-30 3636
3636
