Точные измерения показывают, что чистая дистиллированная вода в незначительной степени электропроводна. Следовательно, вода в некоторой степени диссоцирована, что можно представить уравнением:
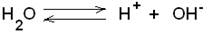
Для обратимых процессов константа диссоциаций (К) выражается уравнением:
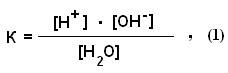
где [Н+ и [OH-] - концентрации ионов Н+ и ОН- при установившемся равновесии диссоциированных и недиссоциированных: молекул воды. Выражается эта концентрация в г-ионах на литр (г-ион/л), 1 г-ион Н+ = I г, I г-ион ОН- = 17 г. [Н2О] - равновесная концентрация недиссоцированных молекул воды, моль/л.
Принимая во внимание, что из 555 млн. молекул воды диссоцирует только одна, можно допустить, что концентрация недиссоцированных молекул воды практически равна общей концентрации воды.
Концентрация воды определяется количеством г-молей воды в I л.Таким образом, зная значения К и [H2O], из уравнения I можно определить величину произведения |Н+] и [OH-]:
|Н+].[OH-] = К . [H2O] = 1,8.10-16 . 55,56 = 1 . 10-14, т.е.
|Н+].[OH-] = 10-14 (2)
Произведение концентрации ионов водорода и ионов гидроксида для воды при постоянной температуре есть величина постоянная и называется ионным произведением воды.
Таким образом, связанные между собой концентрации гидроксид-ионов и ионов водорода являются величинами сопряженными. Следовательно, если добавлением кислоты увеличить концентрацию ионов водорода, то одновременно во столько же раз уменьшится концентрация гидроксид-ионов. Следовательно, по концентрации ионов водорода можно судить о характере среды:
|Н+]= [OH-] = 10-7 - среда нейтральная;
|Н+] > [OH-] > 10-7 - среда кислая;
|Н+] < [OH-] < 10-7 - среда щелочная.
Следует отметить, что характеризовать кислотностъ и щелочность раствора числами с отрицательными показателями степени очень неудобно. Поэтому степень кислотности растворов принято выражать не концентрацией ионов Н+, а ее десятичным логарифмом, взятым с обратным знаком. Эту величину называют водородным показателем и обозначают через рН:
рН = -lg |Н+] (3)
Следовательно, диапазон концентраций ионов водорода, выраженных через рН, будет представлен рядом натуральных чисел по схеме:
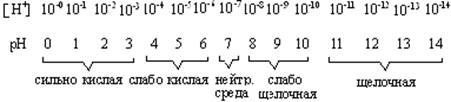
Рис. 1.2. Диапазон концентраций ионов водорода и значений
рН среды
При переводе сН+ в рН следует пользоваться таблицами логарифмов.
 2015-04-30
2015-04-30 630
630








