РОЗДІЛ III ОСНОВИ ТЕОРІЇ СПЛАВІВ
Структура і властивості чистих металів істотно відрізняються від структури і властивостей сплавів, що складаються з двох чи більшого числа металів.
Сплавами називають тверді речовини, отримані шляхом дифузії елементів у твердому, рідкому чи газоподібному станах. Дійсно, мається велике число прикладів, коли сплави одержують шляхом взаємодії металу, що знаходиться у твердому стані, з елементом, що знаходиться в рідкому станів; чи твердого металу з елементом, що знаходиться в газоподібному стані. Однак, як правило, сплави одержують шляхом розплавлювання двох чи більш елементів (металів і неметалів) і наступної кристалізації (затвердіння в різного типу формах і кристалізаторах).
У залежності від числа елементів (компонентів сплаву) розрізняють двухкомпонентные, трикомпонентні чи багатокомпонентні сплави. Між компонентами при утворенні сплаву існує дифузія, тобто взаємне проникнення їхніх атомів з утворенням нових однорідних речовин, називаних фазами сплаву.
У залежності від природи компонентів їхні атоми по-різному взаємодіють один з одним як у рідкому, так і у твердому станах.
У розплавленому стані усі компоненти звичайно знаходяться в атомарному стані, утворити необмежений рідкий однорідний розчин, у будь-якій крапці якого хімічний склад статистично однаковий.
При затвердінні розплаву атоми компонентів укладаються в порядку кристалічних ґрат, утворити тверду кристалічну речовину — сплав. При цьому існують три типи взаємин компонентів сплаву: 1. утворення механічної суміші компонентів; 2. утворення твердих розчинів; 3. утворення з'єднань.
При утворенні механічної суміші компонентів у сплаві атоми кожного компонента укладаються у свої власні кристалічні ґрати, що складаються тільки зі своїх власних ідентичних атомів. Можна заздалегідь передбачати, що при утворенні механічної суміші, коли кожен елемент кристалізується самостійно, властивості сплаву будуть середніми з властивостей елементів, що його утворять. Так, якщо в сплаві один елемент із високою твердістю, а іншої з низкою, те чим більше буде твердого елемента, тим вище буде твердість сплаву.
При утворенні твердого розчину атоми компонентів утворять кристалічні ґрати одного з елементів, що є розчинником, у якій розчинені атоми інших елементів. У кристалічних ґратах сплаву - твердий розчин а атоми основного металу-розчинника займають вузли ґрат, а атоми розчинених компонентів частково заміщають атоми основного чи металу впроваджуються | межузельные простору. При цьому тип ґрат основною металу зберігається.
Утворення загальних кристалічних ґрат з атомів різних елементів, що мають різні атомні діаметри, неминуче зв'язано з деяким перекручуванням ґрат, зміною енергетичного стану атомів, електронів, тобто при утворенні твердих розчинів існує деяка хімічна взаємодія елементів.
У зв'язку з цим властивості сплав-твердих розчинів відрізняються від властивостей елементів, з яких вони складаються, однак основна властивість металу — здатність до пластичної деформації зберігається.
У хімічній сполуці при кристалізації різнорідні атоми можуть з'єднуватися у визначеній пропорції, утворити новий тип ґрат, що відрізняється від ґрат металів сплаву.
Коли утвориться хімічна сполука та його будівля і властивості (кристалічні ґрати, характер зв'язку елементів і т.д.) звичайно різко відрізняються від будівлі і властивостей елементів, з яких воно складається. Утворення хімічної сполуки — процес, при якому створюється нова речовина є новими якостями. Грати з'єднанні мають більш складна будівля, тому з'єднання втрачають здатність до пластичної деформації, мають високу крихкість, а твердість з'єднань у металевих сплавах набагато більше твердості елементів, що входять у них. Так, з'єднання СuА12 має твердість НВ 400, у той час як твердість міді НВ 35, а алюмінію НВ 20.
Як правило, температура плавлення хімічної сполуки відрізняється від температур плавлення елементів, що входять у нього.
Таким чином, властивості сплавів будуть залежати від того, які фази в них утворяться: тверді розчини, хімічні сполуки суміші чистих металів.
Сучасне металознавство дозволяє в багатьох випадках передбачати характер взаємодії елементів у сплавах. Наявні досвідчені дані показують, що розчинність у рідкому стані залежить від атомних обсягів елементів, що сплавляються, і їхніх температур плавлення. Замічено, якщо атомні обсяги двох металів і їхньої температури плавлення різко розрізняються, те в рідкому стані такі елементи мають обмежену розчинність. Це видно з даних табл. 3, у якій показано, що необмежену розчинність у рідкому стані мають пари металів із близькими атомними обсягами і несильно розрізняються температурами плавлення.
Обмежену розчинність мають пари металів з різко відмінними атомними обсягами і температурами плавлення. Однак і з цього часто підтверджується правила є виключення. Так, Fе і Сu мають майже однакові атомні обсяги, і різниця в їхніх температурах плавлення не дуже велика. Однак у рідкому стані вони практично зовсім не розчиняються один в іншому. Те ж відноситься до пари Сu і Сr, коли в розплаві співіснують дві окремих рідини (розшарування рідин), наприклад, одна мідна, інша хромова.
Безсумнівно, що на розчинність елементів у рідкому стані впливають також особливості атомної будівлі й інші фактори.
Розчинність елементів у твердому стані залежить від типу кристалічних ґрат і її параметрів (атомного радіуса, атомного діаметра).
Необмежену розчинність, т, е. здатність утворювати тверді розчини в будь-яких пропорціях, мають тільки метали з кристалічними ґратами одного типу за умови, що параметри їхніх ґрат розрізняються не більше ніж на 14—15 %; припустиме розходження в параметрах для різних металів по-різному. І. І. Корнілов
Таблиця 3. Вплив атомного обсягу і температури плавлення на розчинність металів у рідкому стані
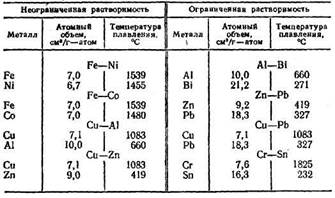
установив, що необмежені тверді розчини в сплавах на основі заліза можуть утворюватися за умови, якщо атомні діаметри елементів, що розчиняються, відрізняються від атомного діаметра заліза не більше ніж на 8 %, (якщо розходження більше 8 %, те утворяться тільки обмежені тверді розчини).
Отже, необмежені тверді розчини схильні утворювати метали, близько розташовані в таблиці Менделєєва, що особливо знаходяться в одній групі, оскільки в більшості випадків кристалічні ґрати в них одного типу.
Дійсно, метали, розташовані недалеко друг від друга в таблиці Менделєєва: Сu (29) і Ni (28)-Fе (26) і Fe (28); Fе (26) і Сr (24); Fе (26) і З (27); З (27) н Ni (28) чи розташовані в одній групі: Аs (33) і Sb (51); Аu (79) і Аg (47); Аu (79) і Сu (29); Ві (83) і Sb (51) (цифри в дужках указують номер елемента в таблиці), мають необмежену розчинність.
У кожну пару входять елементи, що мають той самий тип кристалічних ґрат. елементи з кристалічними ґратами різного типу не розчиняються необмежено у твердому стані. Якщо атоми цих елементів близькі по розмірах, то вони можуть обмежено розчинятися у твердому стані.
Обмежена розчинність можлива і для елементів з різним типом ґрат. Це значить, що вони можуть утворювати тверді розчини не при будь-якім масовому співвідношенні елементів, а до визначеної межі, тобто розчинність їх обмежена, при цьому чим більше різниця в розмірах атомів, тим менше розчинність у твердому стані.
Зі зміною температури обмежена розчинність у твердому стані звичайно міняється.
При дуже великій різниці в атомних розмірах, різному типі кристалічних ґрат, зниженій температурі розчинність може бити настільки мала, що нею практично можна зневажити. У цьому випадку виходить механічна суміш.
Елементи, що утворять хімічні сполуки, звичайно різко розрізняються по електронній будівлі, атомному обсягу, типу і параметрам кристалічних ґрат, т.є.к утворенню хімічних сполук схильні елементи, далеко розташовані один від іншого в таблиці Д. И. Менделєєва.
Наприклад, елементи С, О, Sі й Аl утворять з Fе і Сu наступні хімічні сполуки: Fе3С, FеО, Fе2O3, FеSі2, СuА12 і ін.
Отже, взаємодія елементів у сплавах і характер структури, що утвориться, визначаються положенням елементів у таблиці Д. И. Менделєєва, типом кристалічних ґрат, розмірами атомів, тобто фізичною природою елементів.
Незважаючи на те, що приведені положення надзвичайно важливі, тому що вони в загальному виді вказують на характер взаємодії елементів у сплавах і можливій структурі, що при цьому повинна вийти, все-таки в кожнім конкретному випадку для сплавів з даної конкретної парі (чи більшого числа) елементів необхідно з'ясовувати характер цієї взаємодії досвідченим шляхом. Тому в металознавстві велику увагу приділяють експериментальним дослідженням конкретних сплавів. З цією метою виготовляють сплави, для яких будують криві охолодження, криві нагрівання; після затвердіння сплави піддають мікроскопічному аналізу для з'ясування їхньої мікроструктури; рентгенівському аналізу, що дозволяє виявити тип кристалічних ґрат, параметри ґрат і т.д.
Отримані в результаті досліджень дані систематизують, узагальнюють у виді діаграм стану, що відображають взаємодія елементів у цих сплавах, будівля, що утвориться при кристалізації, зміна будівлі при чи нагріванні охолодженні й інших важливих властивостях, що характеризують стан сплавів різного складу при різних температурах.
 2015-04-30
2015-04-30 2165
2165