Щелочь:
| 1.щёлочь + кислота | NaOH +HCl 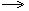 NaCl + H2O Na+ + OH- + H+ + Cl- NaCl + H2O Na+ + OH- + H+ + Cl- 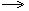 Na++ Cl- + H2O H+ +OH- Na++ Cl- + H2O H+ +OH- 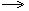 H2O H2O |
| 2.щёлочь + кислотный оксид | 2NaOH +CO2 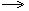 Na2CO3 + H2O 2Na+ + 2OH- + CO2 Na2CO3 + H2O 2Na+ + 2OH- + CO2  2Na+ + CO32- + H2O 2OH- + CO2 2Na+ + CO32- + H2O 2OH- + CO2  CO32- + H2O CO32- + H2O |
| 3.щёлочь + соль | 2NaOH +MgCl2  Mg(OH)2 Mg(OH)2  + 2NaCl 2Na+ + 2OH-+ Mg2++ 2Cl- + 2NaCl 2Na+ + 2OH-+ Mg2++ 2Cl- 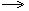 Mg(OH)2 Mg(OH)2 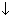 +2 Na++2 Cl- 2OH-+ Mg2+ +2 Na++2 Cl- 2OH-+ Mg2+ 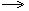 Mg(OH)2 Mg(OH)2 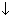 |
Нерастворимые основания:
все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов Са/ОН/2 = СаО + Н2О
характерная реакция - реакция нейтрализации Са/ОН/2 + Н2СО3 = СаСО3 + Н2О
реагируют с кислотными оксидами Са/ОН/2 +СО2 = СаСО3 +Н2О
с кислыми солями Са/ОН/2 + 2КНСО3 = К2СО3 +СаСО3 + 2Н2О
щелочи вступают в обменную реакцию с солями. если при этом образуется осадок 2NaOH + CuCl2 = 2NaCl + Cu/OH/2 /осадок/
растворы щелочей реагируют с неметаллами.а также с алюминие или цинком. ОВР.
 2015-05-14
2015-05-14 967
967








