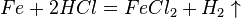Свойства кислот определяются тем, что они способны заменять в своих молекулах атомы водорода на атомы металлов. Например:
| H2SO4 | + | Mg | = | MgSO4 | + | H2 |
| серная кислота | металл | соль | водород |
| H2SO4 | + | MgO | = | MgSO4 | + | H2O |
| серная кислота | оксид | соль | вода |
Взаимодействие кислот с основаниями. Эта реакция, как вы уже знаете, называется реакцией нейтрализации. Кислота реагируют с основанием с образованием соли, в которой всегда в неизменном виде обнаруживается кислотный остаток. Вторым продуктом реакции нейтрализации обязательно является вода. Например:
| кислота | основание | соль | вода | |||
| H2SO4 | + | Ca(OH)2 | = | CaSO4 | + | 2 H2O |
| H3PO4 | + | Fe(OH)3 | = | FePO4 | + | 3 H2O |
| 2 H3PO4 | + | 3 Ca(OH)2 | = | Ca3(PO4)2 | + | 6 H2O |
Взаимодействие кислот с основными оксидами. Поскольку основные оксиды – ближайшие родственники оснований – с ними кислоты также вступают в реакции нейтрализации:
| кислота | оксид | соль | вода | |||
| 2 HCl | + | CaO | = | CaCl2 | + | H2O |
| 2 H3PO4 | + | Fe2O3 | = | 2 FePO4 | + | 3 H2O |
Взаимодействие кислот с металлами. Как мы видим из предыдущего примера, для взаимодействия кислот с металлом должны выполняться некоторые условия (в отличие от реакций кислот с основаниями и основными оксидами, которые идут практически всегда).
Во-первых, металл должен быть достаточно активным (реакционноспособным) по отношению к кислотам. Например, золото, серебро, медь, ртуть и некоторые другие металлы с выделением водорода с кислотами не реагируют. Такие металлы как натрий, кальций, цинк – напротив – реагируют очень активно с выделением газообразного водорода и большого количества тепла.
| кислота | металл | соль | ||||
| HCl | + | Hg | = | не образуется | ||
| 2 HCl | 2 Na | = | 2 NaCl | + | H2 | |
| H2SO4 | + | Zn | = | ZnSO4 | + | H2 |
14 Со́ли — вещества, в которых атомы металла связаны с кислотными остатками. 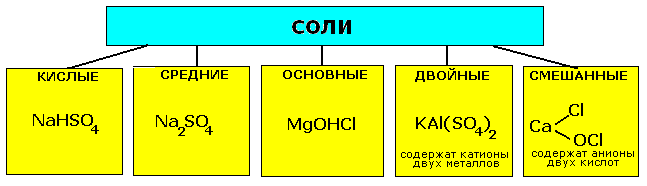 Химические свойства. 1.Химические свойства средних солей: 1. Термическое разложение. CaCO3 = CaO + CO2 2Cu(NO3)2 = 2CuO + 4NO2 + O2 NH4Cl = NH3 + HCl 2. Гидролиз. Al2S3 + 6H2O = 2Al(OH)3 + 3H2S FeCl3+ H2O = Fe(OH)Cl2 + HCl Na2S + H2O = NaHS +NaOH 3. Обменные реакции с кислотами, основаниями и другими солями. AgNO3 + HCl = AgCl + HNO 3 Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO 3 CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl AgCl + 2Na2S2O3 = Nа3[Ag(S2O3) 2] + NaCl 4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl+5Cl2 +8H2O 2.Химические свойства кислых солей: 1. Термическое разложение с образованием средней соли Ca(HCO3)2 = CaCO3 + CO2 + H2O 2. Взаимодействие со щёлочью. Получение средней соли. Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O 16 Современная формулировка: Свойство элементов, а также форма и свойств их соединения находящихся в периодической зависимости от заряда их атомных ядра Все элементы периодической системы подразделяются на четыре типа: 1. У атомов s–элементовзаполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода. 2. У атомов р–элементовэлектронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого). 3. У d–элементовзаполняется электронами d–оболочка второго снаружи уровня (n–1) d. Это элементы вставных декад больших периодов, расположенных между s– и p– элементами. Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует: · Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах. · Номер периода совпадает с главным квантовым числом внешних электронов атома. · s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. · Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. Элементы с валентными d– или f–электронами называются переходными. Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8. Химические свойства. 1.Химические свойства средних солей: 1. Термическое разложение. CaCO3 = CaO + CO2 2Cu(NO3)2 = 2CuO + 4NO2 + O2 NH4Cl = NH3 + HCl 2. Гидролиз. Al2S3 + 6H2O = 2Al(OH)3 + 3H2S FeCl3+ H2O = Fe(OH)Cl2 + HCl Na2S + H2O = NaHS +NaOH 3. Обменные реакции с кислотами, основаниями и другими солями. AgNO3 + HCl = AgCl + HNO 3 Fe(NO3)3 + 3NaOH = Fe(OH)3 + 3NaNO 3 CaCl2 + Na2SiO3 = CaSiO3 + 2NaCl AgCl + 2Na2S2O3 = Nа3[Ag(S2O3) 2] + NaCl 4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона. 2KMnO4 + 16HCl = 2MnCl2 + 2KCl+5Cl2 +8H2O 2.Химические свойства кислых солей: 1. Термическое разложение с образованием средней соли Ca(HCO3)2 = CaCO3 + CO2 + H2O 2. Взаимодействие со щёлочью. Получение средней соли. Ba(HCO3)2 + Ba(OH)2 = 2BaCO3 + 2H2O 16 Современная формулировка: Свойство элементов, а также форма и свойств их соединения находящихся в периодической зависимости от заряда их атомных ядра Все элементы периодической системы подразделяются на четыре типа: 1. У атомов s–элементовзаполняются s–оболочки внешнего слоя (n). К s–элементам относятся водород, гелий и первые два элемента каждого периода. 2. У атомов р–элементовэлектронами заполняются р–оболочки внешнего уровня (np). К р -элементам относятся последние 6 элементов каждого периода (кроме первого). 3. У d–элементовзаполняется электронами d–оболочка второго снаружи уровня (n–1) d. Это элементы вставных декад больших периодов, расположенных между s– и p– элементами. Из рассмотрения электронной структуры невозбужденных атомов в зависимости от порядкового номера элемента следует: · Число энергетических уровней (электронных слоев) атома любого элемента равно номеру периода, в котором находится элемент. Значит, s–элементы находятся во всех периодах, р–элементы – во втором и последующих, d–элементы – в четвертом и последующих и f–элементы – в шестом и седьмом периодах. · Номер периода совпадает с главным квантовым числом внешних электронов атома. · s– и p–элементы образуют главные подгруппы, d–элементы – побочные подгруппы, f–элементы образуют семейства лантаноидов и актиноидов. · Номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. Элементы с валентными d– или f–электронами называются переходными. Номер группы, как правило, равен высшей положительной степени окисления элементов, проявляемой ими в соединениях. Исключением является фтор – его степень окисления равна –1; из элементов VIII группы только для Os, Ru и Xe известна степень окисления +8.
Обратимые реакции. — химические реакции, протекающие одновременно в двух противоположных направлениях, например: 3H2 + N2 ⇌ 2NH3. |
 2015-05-14
2015-05-14 1163
1163