«Выполнение опытов, демонстрирующих генетическую связь между основными классами неорганических веществ «
Окислительно-восстановительные реакции.
ОВР — это реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества.
Восстановитель — это элемент или вещество, отдающее электроны. Само оно при этом окисляется.
Окислитель – это элемент или вещество, принимающее электроны. Само оно при этом восстанавливается.
 Некоторые активные окислители:
Некоторые активные окислители:
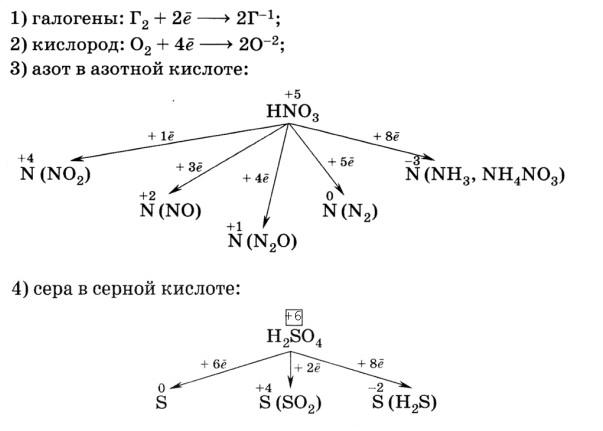
Некоторые активные восстановители:
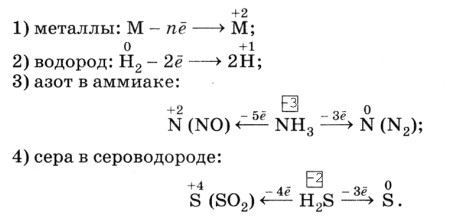
Самым сильным восстановителем среди элементов IVA группы является: свинец
Т. к. восстановительные свойства в группе сверху вниз усиливаются, то в 4 группе самым сильным восстановителем будет свинец – он ниже всех остальных.
Наиболее слабым окислителем среди элементов VA группы является: сурьма
Т. к. окислительные свойства элементов в группе сверху вниз ослабевают и ниже всех сурьма, то она будет самым слабым окислителем.
Окислительная активность галогенов возрастает от йода к фтору, потому что: увеличивается их электроотрицательность
Максимальное значение степени окисления хлор проявляет в соединении, формула которого: Сl2O7
Наименьшую степень окисления сера проявляет: в сульфиде калия
Сероводород проявляет только восстановительные свойства.
Сероводород (H2S) не может быть окислителем, т. к. сера в данном соединении имеет минимальную степень окисления -2, ее внешний энергетический уровень полностью заполнен электронами, т. е. она уже больше не в состоянии принимать электроны, она может только отдавать их (проявляет только восстановительные свойства).
Домашнее задание: параграф 43, упр.1,2,3
 2015-05-14
2015-05-14 2181
2181








