С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид - ион
NaOH 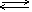 Na++ OH- Ba(OH)2 Na++ OH- Ba(OH)2 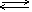 Ba2++ 2OH- NH3·H2O Ba2++ 2OH- NH3·H2O 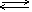 NH4++ OH- NH4++ OH- |
Основания - гидроксиды металлов- веществы-электролиты которые распадаются/диссоциируют/ только на положительно заряженные ионы металла - катионы и отрицательно заряженные гидроксид ионы -анионы. Классификация - растворимые в воде. щелочи и NH4OH и нерастворимые.
Химические свойства:
1)все нерастворимые в воде основания при нагревании разлагаются с образованием оксидов Са(ОН)2 = СаО + Н2О
2) характерная реакция - реакция нейтрализации Са(ОН)2 + Н2СО3 = СаСО3 + Н2О
3) реагируют с кислотными оксидами Са(ОН)2 +СО2 = СаСО3 +Н2О
4)с кислыми солями Са(ОН)2 + 2КНСО3 = К2СО3 +СаСО3 + 2Н2О
5) щелочи вступают в обменную реакцию с солями, если при этом образуется осадок 2NaOH + CuCl2 = 2NaCl + Cu(OH)2
6)растворы щелочей реагируют с неметаллам,а также с алюминием или цинком. ОВР.
Домашнее задание: параграф 39, упр.3-5
 2015-05-14
2015-05-14 2375
2375
