1. Массасы 24,8 г бір валентті белгісіз металдың оксиді судың 175,2г массасында ерітілген. Егер берілген құрамындағы оттектің массалық үлесі 25,8% болса, онда түзілген ерітіндідегі еріген заттың массалық үлесі қандай болады?
2. Массасы 3,04 г белгісіз металл 9,125 г белгісіз қышқылмен қалдықсыз әрекеттескенде, 2,8 л (қ.ж.) сутек бөлінген. Осы қышқылдың берілген массасын толық бейтараптау үшін 10,0 г күйдіргіш натр қажет болған. Бастапқыда алынған белгісіз металл мен белгісіз қышқылды табыңдар.
3. Массасы 21,0 г екі валентті белгісіз металл карбонатын қыздырғанда, айырылу реакциясы жүрген. Нәтижесінде көлемі 5,6л (қ.ж.) көміртек (ІV) оксиді түзілген. Осы белгісіз тұздың молекулалық формуласын анықтаңдар.
4. Периодтық жүйедегі ІІ топта орналасқан, массасы 3,42г белгісіз металдың гидроксидінен массасы 5,94г осы металдың бромиді алынған. Белгісіз металл гидроксидінің молекулалық формуласын табыңдар
5. Массасы 4,7 г белгісіз металды жаққанда, оның 8,88 г оксиді түзілген. Осы оксидке КОН ерітіндісімен әсер еткенде – КМеО2 қосылысы алынған. Бұл қандай металл
6. Күкірт қышқылының 18%-тік 300 г ерітіндісіне 300 мл су қосылды. Алынған ерітіндідегі Н2SO4-тің массалық үлесі
7. Магний хлоридінің 28% ерітіндісін алу үшін оның 240 г 10% ерітіндісіне қосылатын тұздың массасы
8. Магний хлоридінің 10%-тік 240 г ерітіндісіне 60 г тұз қосылды. Алынған ерітіндідегі MgCl2-нің массалық үлесі
9. A+B 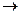 2C реакция теңдеуінде А затының бастапқы концентрациясы 0,22 моль/л, ал 10 сек өткеннен кейін 0,215 моль/л болса,реакцияның орташа жылдамдығы
2C реакция теңдеуінде А затының бастапқы концентрациясы 0,22 моль/л, ал 10 сек өткеннен кейін 0,215 моль/л болса,реакцияның орташа жылдамдығы
10. 300 г 7% және 200 г 2%тік бромсутек қышқылы ерітінділерін араластырғанда алынған қышқылдың массалық үлесі
11. MgSO4-тің 200 г 20%-тік ерітіндісін әзірлеуге қажет MgSO4×7H2O мен судың массалары
12. 44,8 л сутегі (қ.ж.) хлормен әрекеттескенде бөлінетін жылу мөлшері H2+Cl2=2HCl+184,6 кДж
13. Сусыз MnSO4·-тің 20 % ерітіндісін алу үшін 100 моль суда еритін MnSO4··5H2O-ның мөлшері
14. Массасы 11,6г темірдің белгісіз оксидін тотықсыздандыруға көлемі 4,48л (қ.ж.) сутек жұмсалған. Реакцияға темірдің қандай оксиді қатысқан?
15. 10,4г темір және магний металдарының қоспасын тұз қышқылымен әрекеттестіргенде, 6,72л (қ.ж.) сутек бөлінген. Қоспадағы металдардың әрқайсысының массаларын есептеңдер.
16. 8,0г темір пластинкасын біраз уақыт массасы 250г, массалық үлесі 15% мыс (ІІ) сульфаты ерітіндісінде ұстағанда, пластинканың массасы 8,77г артқан. Реакциядан кейінгі ерітіндідегі мыс сульфатының массалық үлесін табыңдар
17. 750 кг 48 % күкірт қышқылы ерітіндісінен 300 кг суды суалтқан кезде пайда болған күкірт қышқылының проценттік мөлшері
18. Массасы 5 г барий хлоридін 495 г суда ерітті. Ерітіндідегі барий хлоридінің BaCl2 массалық үлесі
19. Массасы 500 г суда 80 г натрий хлориді ерітілген. Ерітіндідегі еріген заттың массалық үлесін анықтаңыз
20. 10 -проценттік ерітінді алу үшін 50 г 30-проценттік натрий сульфатының ерітіндісіне құйылатын судың массасы
21. Көлемі 250 мл ерітіндіде массасы 6,3 г азот қышқылы бар - HNO3. Ерітіндінің молярлық концентрациясы
22. 1 литрінде 224 г HNO3 (r = 1,12 г/мл) бар ерітіндідегі азот қышқылының массалық үлесі
23. Еріген затының массалық үлесі 25% болатын 300 г қант ерітіндісін даярлауға қажетті судың массасы
24. Натрий сульфатының 500 г 6 %-ті және 200 г 13 %-ті ерітінділерін қосқанда алынған ерітіндідегі Na2SO4-тің массалық үлесі
25. Калий хлоридінің 250 г 6 %-ті ерітіндісіне 50 г су қосқанда алынған ерітіндідегі KCl-дың массалық үлесі
26. Тұз қышқылының 240 г 20 %-ті ерітіндісіне 160 г су қосқанда алынған ерітіндідегі HCl-дың массалық үлесі
27. Калий нитратының 200 г 2 %-ті және 100 г 5 %-ті ерітінділерін қосқанда алынған ерітіндідегі KNO3-тің массалық үлесі
28. 332 мл суда 68 г калий сульфатын еріткенде алынған ерітіндідегі K2SO4 -тің массалық үлесі
29. Фосфор қышқылының 400 г 10 %-ті және 200 г 4 %-ті ерітінділерін қосқанда алынған ерітіндідегі H3PO4-тің массалық үлесі
30. 20 г 4,9 %-ті күкірт қышқылы ерітіндісін бейтараптауға 10%-ті натрий гидроксиді ерітіндісінің қажет массасы
3. Органикалық химияның теориялық негіздері
Органикалық химия пәніне кіріспе
Органикалық химия пәні. Органикалық қосылыстар. Органикалық химияның басқа ғылымдармен байланысы, оның өнеркәсіп, мәдениет үшін маңызы және халықтың әл-ауқатын көтерудегі ролі. өсімдіктерді зиянкестерден қорғайтын химиялық заттар, химиялық талшықтар, пластмассалар, синтетикалық каучуктер, синтетикалық жуғыш заттар, дәрі дәрмектер, лактар, бояулар мен басқа өнімдер өндірісі. Органикалық химияның материалистік көзқарастарды қалыптастырудағы маңызы.
Органикалық заттарды зерттеу әдістері жеке заттарды бөліп алу тәсілдері. Органикалық қосылыстардың сапалық және сандық анализі. Физико-химиялық әдістер мен заттардың құрылысын тағайындау.
А.М. бутлеровтың химиялық құрылыс теориясы. Теорияның негізгі қағидалары. Молекулалардағы атомдардың өзара әсері. Теорияның маңызы.
1.Химиялық байланыстың электрондық теориясы.
Квантхимиялық ұғымдар мен зерттеудің физика-химиялық әдістерінің органикалық химияның дамуына ықпал. Иондық және ковалентті байланыс. Семиполярлық байланыс-ковалентті және иондық байланыстардың комбинациясы, сутек байланысы туралы түсінік. Ковалентті байланысты кванттық механика тұрғысынан түсіндіру.
Льюистің октет формулалары. Молекуладағы атомдардың тиімді және формальді зарядтары туралы түсінік. Изоэлектрондық құрылымдар туралы түсінік.
Квантты байланыстың сипаттамасы: энергиясы, ұзындығы, еселігі, полюстілігі, поляризацияланғыштығы, кеңістіктегі бағыты. Валенттілік, ковалеттілік, координациялық сан туралы түсінік.
2.Бағытталған валенттіліктер теориясы
Элементтердің электрондық құүрылысымен, олардың иондарының заряды және молекула немесе ион құрамындағы коваленттік байланыстар санының арасындағы тәуелділік. Изоэлектрондық құрылымдар мысалдары: метан, аммоний және боргидрид иондары, метил катионы, гидроксоний ионы, аммиак және т.б.
Гибриттелу теориясы. Көміртегі атомының үш түрлі валенттілік күйі, молекуладағы атомдардың гибриттелуін анықтау ережелері. Көміртегі атомының тетраэдрлік (Sp3)гибриттелуі. Sp3- гибриді орбиталдағы электрондық тығыздықтың таралуы. Оттегі мен азот атомдарының тетраэдрлік гибриттелуі. Этан, пропан, су және аммиак молекулаларының электондық құрылысы және валенттік бұрышытары. Метан, этил спирті, метиламин молекулаларының электрондық құрылысы және молекулалардың полюстілігі.
Тригоналдық (Sp2) гибридтелу. Қос байланысты молекулалардың моделі, σ және π байланыстардың схемасы, этилен, пропилен, бутадиен молекулаларындағы валенттік бұрыштар. Оттегі және азот атомдарының тригональдық гибридтелуі. Сірке қышқылы, нитрометан,мочевина және т.б. қосылыстар молекулаларындағы σ және πбайланыстар схемасы.
Диагоналдық (Sp) гибриттелу. Үш байланысты қосылыстардың моделі, ацетилен, аллен (IV)оксиді молекулаларындағы σжәне π–байланыстар схемасы.
Этан, этилен және ацетилен молекулаларындағы жай байланыс, қос және үш байланыстардың энергиясы, ұзындығы және полюстенуі. Электртерістілік мәні және коваленттік радиус ұзындығының көміртегі атомының валенттік күйіне тәуелділігі. Алкандар, алкендер және алкиндердегі С-Н байланысының энергиясы, ұзындығы және полюстілігі.
3.Электрондардың ығысу теориясы
Индукциялық эффект, оның σ-байланыстың полюстілігінің элементтердің электр терістілігіне тәуелділігі. Полинг бойынша элементтердің электр терістілік кестесі. Индукциялық эффект таңбаларының (+I;-I) орынбасушылардың электртерістілігіне тәкелділігі. Индукциялық эффектінің σ байланыс тізбегі бойынша бәсеңдетуі. Индукциялық эффектінің заттардың физикалық және химиялық қасиеттеріне әсері.
Мезомерлік эффект (резонанс эффектісі немесе қосарлану эффектісі)π- байланыстар жүйесіндегі электондық тығыздықтың қайта бөлінуі, жүйенің тұрақтылығы. Полюссіз (М) және полюсті(+М;-М) мезомерлік эффектілер. Қосарлану типтері: π-π, π-ρ, ρ-π, π-σ, σ-σ.
Шектелген (резонанстық) стуктуралар, мезоформулалар. П-МО, біртұтас көрініс, центрлер және П-электрондар саны. Резонанс энергиясы және оның жүйе тұрақтылығына әсері. Мезомерлік эффектінің заттар физико-химиялық қасиеттеріне әсері.
 2015-05-14
2015-05-14 6584
6584








