Электрохимические процессы – это гетерогенные ОВР, в которых происходит перенос заряда и вещества через поверхность раздела фаз. Они сопровождаются взаимным превращением химической и электрической энергии. В гальванических элементах энергия химической реакции преобразуется в электрическую. В процессах электролиза пропускание электрического тока через водный раствор вызывает химические реакции.
Электрод – это гетерогенная система, представляющая собой проводник первого рода (чаще всего металл, обладающий электронной проводимостью), погруженный в раствор электролита.
В электрохимии электрод, на котором идут окислительные процессы, называют анодом. Электрод, на котором идут восстановительные процессы, называют катодом.
В металлической решетке существует подвижное равновесие:
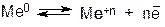
где Ме0 – атом металла, Ме+n – катион металла, n – заряд катиона и число отданных электронов.
Если поместить металл в воду, то под действием полярных молекул (диполей) воды часть катионов металла переходит с его поверхности в водную среду, в которой они существуют в гидратированном (сольватированном) состоянии:
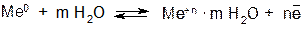

В результате этого процесса на поверхности металла возникает избыток электронов, поэтому она заряжается отрицательно.
Часть гидратированных катионов металла из объема воды притягиваются к отрицательно заряженной поверхности металла, формируя двойной электрический слой (ДЭС) в виде плоского конденсатора. В результате между металлом и раствором возникает разность потенциалов:.
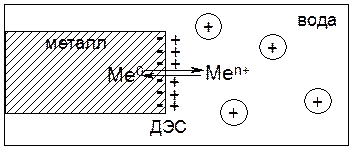
При установлении в данной системе равновесия, которое характеризуется определенным значением концентраций электронов на поверхности электрода и катионов металла в растворе, возникает разность потенциалов, которую называют электродным потенциалом металла и обозначают ЕMe0/Меn+, В.
По способности катионов металла переходить в раствор электролита все металлы делятся на активные, средней активности и неактивные.
Металлы, в соответствии с величинами их электрохимической активности, образуют электрохимический ряд напряжений металлов, в котором приведены значения их стандартных электродных потенциалов (с.э.п.). С.э.п. – это разность потенциалов, возникающая между нормальным водородным электродом (его потенциал условно принят равным нулю) и электродом из данного металла, находящегося в стандартных условиях: металл погружен в раствор собственной соли с концентрацией его катионов 1 моль на 1000 г воды при 298 К.
В ряду напряжений к активным относятся металлы от Li до Fe, к металлам средней активности – стоящие между Fe и H2, к неактивным – стоящие правее водорода.
Величина электродного потенциала металла зависит не только от его природы, но и от концентрации его катионов в растворе и температуры. Зависимость электродного потенциала от концентрации катионов металла в растворе выражается уравнением Нернста:
Ес= Е0 + 0,059/n . lgСm
где Сm – моляльная концентрация катионов металла в растворе (моль/1000 г воды);
n – заряд катиона металла;
Ео – стандартный электродный потенциал данного металла, В;
Ес – потенциал металла при концентрации его катионов, не равной 1, В.
Список рекомендуемой литературы
1. Глинка Н.Л. Общая химия. – М.: Юрайт, 2013; М.: Интеграл-пресс, 2009 и др. годы изд.
2. Коровин Н.В. Общая химия. – М.: Высшая школа, 2013 и др. годы изд.
3. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 2010 и др. годы изд.
4. Денисов В.В., Дрововозова Т.И., Лозановская И.Н. Химия. – М.; Ростов-н/Д: Издат. центр. "Март Т", 2008 и др. годы изд.
5. Гельфман М.И., Юстратов В.П. Химия. – СПБ.: Лань, 2008 и др. годы изд.
6. Рябов В.Д. Химия нефти и газа. – М.: Изд-во "Техника". ТУМА ГРУПП, 2010 и др. годы изд.
Приложение
Классификация электролитов по степени их диссоциации
| Вещество | Сильные электролиты α >30% | Слабые электролиты α <30% |
| Основания | KOH, NaOH, Ba(OH)2, TiOH | NH4OH, все нерастворимые основания и амфотерные гидроксиды |
| Кислоты | HСl, HBr, HI, HNO3, H2SO4, H2MnO4, HСlO3, HClO4 | HF, H2CO3, H2SO3, HNO2, H3PO4, HCN, H2S, H2SiO3, большинство органических кислот (CH3COOH и др.) |
| Соли | все растворимые соли – средние, кислые и гидроксо-нитраты (основные соли, содержащие группу NO3) | все малорастворимые и нерастворимые соли –основные (кроме гидроксонитратов) и средние |
Константы диссоциации водных растворов некоторых кислот при 25оС
| Электролит | Формула | Значение константы диссоциации КД |
| Азотная | HNO3 | 4,36 ∙101 |
| Азотистая | HNO2 | 4 ∙10-1 |
| Борная | H3BO3 | (1)5,8 ∙10-10 (2)1,8 ∙10-10 (3)1,6 ∙10-14 |
| Бромноватистая | HBrO | 2,1 ∙10-9 |
| Бромоводородная | HBr | 1 ∙109 |
| Йодноватистая | HIO | 2,3 ∙10-11 |
| Йодноватая | HIO3 | 1,7 ∙10-1 |
| Йодная | HIO4 | 2,3 ∙10-2 |
| Йодистоводородная | HI | 1 ∙1011 |
| Кремниевая | H2SiO3 | (1)2,2 ∙10-10 (2)1,6 ∙10-12 |
| Малеиновая | HOOCCH=CHCOOH | (1)1,2 10-2 (2)5,9 ∙10-7 |
| Марганцовая | HMnO4 | 2 ∙102 |
Продолжение таблицы
| Электролит | Формула | Значение константы диссоциации КД |
| Муравьиная | HCOOH | 1,77 ∙10-4 |
| Мышьяковистая | HAsO2 | 6 ∙10-10 |
| Мышьяковая | H3AsO4 | (1) 5,89 ∙10-3 (2) 1,05 ∙10-7 (3) 3,89 ∙10-12 |
| Ортофосфорная | H3PO4 | (1)7,52 ∙10-3 (2)6,31 ∙10-8 (3)1,26 ∙10-12 |
| Серная | H2SO4 | (1)1 ∙103 (2)1,2 ∙10-2 |
| Сернистая | H2SO3 | (1)1,58 ∙10-2 (2)6,31∙ 10-8 |
| Сероводородная | H2S | (1)6 ∙10-8 (2)1∙ 10-14 |
| Угольная | H2CO3 | (1)4,45 ∙10-7 (2)4,69 ∙10-11 |
| Уксусная | CH3COOH | 1,754 ∙10-5 |
| Фтороводородная | HF | 6,01 ∙10-4 |
| Хлорноватистая | HClO | 5,01 ∙10-8 |
| Хлороводородная | HCl | 1 ∙107 |
| Хромовая | H2CrO4 | (1)1∙ 101 (2)3,16∙10-7 |
| Циановодородная | HCN | 7,9 ∙10-10 |
| Щавелевая | HOOC-COOH | (1)5,4 ∙10-2 (2)5,4∙10-5 |
| Яблочная | HOOCCH(OH)CH2COOH | (1)3,9 ∙10-4 (2)7,8 ∙10-6 |
| Янтарная | HOOC(CH2)2COOH | (1)6,19 ∙10-5 (2)2,30 ∙10-6 |
Константы диссоциации некоторых неорганических оснований
| Основание | Формула | Значение константы диссоциации КД |
| Гидроксид алюминия | Al(OH)3 | (3) 1,38 ∙10-9 |
| Гидроксид аммония | NH4OH | 6,3 ∙10-5 |
| Гидроксид бария | Ba(OH)2 | 2,3 ∙10-1 |
| Гидроксид ванадия | V(OH)3 | (3) 8,3 ∙10-12 |
| Гидроксид железа (II) | Fe(OH)2 | (2) 1,3 ∙10-4 |
| Гидроксид железа (III) | Fe(OH)3 | (3) 1,35 ∙10-12 |
| Гидроксид кадмия | Cd(OH)2 | 5,0 ∙10-3 |
| Гидроксид кальция | Ca(OH)2 | (2) 4,3 ∙10-2 |
| Гидроксид кобальта | Co(OH)2 | 4 ∙10-5 |
| Гидроксид магния | Mg(OH)2 | (2) 2,5 ∙10-3 |
| Гидроксид марганца | Mn(OH)2 | (2) 5 ∙10-4 |
| Гидроксид меди | Cu(OH)2 | (2)3,4 ∙10-7 |
| Гидроксид натрия | NaOH | 5,9 ∙1 |
| Гидроксид никеля | Ni(OH)2 | (2) 2,5 ∙10-5 |
| Гидроксид хрома | Cr(OH)3 | (3) 1,02 ∙10-10 |
| Гидроксид цинка | Zn(OH)2 | (2) 4 ∙10-5 |
Взаимосвязь концентраций ионов Н+, величины водородного показателя (рН) и окраски индикаторов
| Концентрация ионов Н+ | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 | 10-6 | 10-7 | 10-8 | 10-9 | 10-10 | 10-11 | 10-12 | 10-13 | 10-14 |
| Величина водородного показателя | ||||||||||||||
| Индикаторы | Окраска индикаторов | |||||||||||||
| Лакмус | ярко- крас ный | ярко- крас ный | ярко- крас ный | крас ный | крас ный | слабо- крас ный | фиоле товый | слабо- синий | синий | синий | ярко- синий | ярко- синий | ярко- синий | ярко- синий |
| Фенолфталеин | мали новый | мали новый | мали новый | мали новый | мали новый | мали новый | ||||||||
| Метилоранж | ярко- крас ный | ярко- крас ный | ярко- крас ный | крас ный | крас ный | светло- оран жевый | оран жевый | светло- оран жевый | жёлтый | жёлтый | жёлтый | жёлтый | ярко- жёлтый | ярко- жёлтый |
Растворимость кислот, оснований и солей в воде
| Анионы | Катионы | ||||||||||||||||||||||
| H+ | Li+ | K+, Na+ | NH4+ | Sr2+ | Ba2+ | Ca2+ | Mg2+ | Al3+ | Cr3+ | Fe2+ | Fe3+ | Ni2+ | Co2+ | Mn2+ | Zn2+ | Ag+ | Hg2+ | Pb2+ | Be2+ | Cd2+ | Sn2+ | Cu2+ | |
| OH- | Р | Р | Р | Р | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | – | – | H | H | H | H | H | |
| F- | Р | Н | Р | Р | Н | М | Н | М | М | М | М | Н | Р | Р | Р | М | Р | – | М | Р | Р | Р | Р |
| Cl- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р | Р | Р |
| Br- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р | Р | Р |
| I- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | Р | Р | Н | Н | Н | Р | Р | М | – |
| S2- | Р | Р | Р | Р | Р | Р | Р | Р | – | – | Н | – | Н | Н | Н | Н | Н | Н | Н | – | Н | Н | Н |
| SO32- | Р | Р | Р | Р | Н | Н | Н | Н | – | – | Н | – | Н | Н | Н | Н | Н | – | Н | Н | Р | – | – |
| SO42- | Р | Р | Р | Р | Н | Н | М | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Н | Р | Р | Р | Р |
| CrO42- | Р | Р | Р | Р | М | Н | М | Р | – | – | – | – | – | – | Н | Н | Н | Н | Н | (?) | (?) | – | Н |
| PO43- | Р | Н | Р | Р | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO32- | Р | Р | Р | Р | Н | Н | Н | Н | – | – | Н | – | – | – | Н | – | Н | – | – | – | – | – | – |
| SiO32- | Н | Р | Р | Н | Н | Н | Н | Н | Н | – | Н | Н | – | – | Н | Н | – | – | Н | (?) | (?) | – | Н |
| NO3- | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р |
| CH3COO- | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | + | Р | Р | Р |
 2015-05-14
2015-05-14 611
611







