Любое вещество состоит из формульных (структурных) единиц или частиц (ФЕ). Формульные единицы в химии – это реально существующие частицы, такие как атомы, молекулы, ионы, радикалы, условные молекулы или другие частицы вещества. Количество вещества nВ – физическая величина, пропорциональная числу формульных единиц этого вещества (NФЕ);
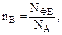
где NA – постоянная Авогадро. Единица количества вещества – моль.
Моль – это количество вещества, содержащее столько формульных единиц, сколько атомов содержится в 0,012 кг изотопа углерода 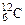 .
.
Кроме формульных единиц в химии применяют такое понятие, как “эквиваленты”. В некоторых химических реакциях условно принимает участие не целая формульная единица, а лишь ее часть, называемая эквивалентом. Эквиваленты – условные частицы вещества, в ZB раз меньше, чем соответствующие или формульные единицы: 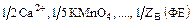 . Число ZB называют эквивалентным числом, ZB³1. Число ZB является безразмерным и определяется химической реакцией, в которой данное вещество участвует.
. Число ZB называют эквивалентным числом, ZB³1. Число ZB является безразмерным и определяется химической реакцией, в которой данное вещество участвует.
Эквивалент (Э) – это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в обменных реакциях или одному электрону в данной окислительно-восстановительной реакции. Эквивалент – безразмерная величина.
Количество вещества эквивалентов В, символ nэк(В): 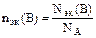 . Единица измерения – моль. Так как в одной формульной единице вещества В может содержаться ZB эквивалентов этого вещества, то Nэк(B)= ZBNФЕ. Отсюда nэк(B)= ZB×nВ.
. Единица измерения – моль. Так как в одной формульной единице вещества В может содержаться ZB эквивалентов этого вещества, то Nэк(B)= ZBNФЕ. Отсюда nэк(B)= ZB×nВ.
Масса атома любого элемента равна произведению его относительной атомной массы на атомную единицу массы:
mЭ=Ar×(а.е.м.) (см. табл. П1)
m(молекулы)=Мr×(а.е.м.).
Молярная масса вещества В (символ МВ, единица измерения г/моль) – это масса одного его моля или масса вещества В (символ mB), деленная на количество вещества, nB: MB=mB/nB. Термин “молярная масса” относится не только к массе моля молекул, но и к массе моля атомов, ионов, радикалов.
Молярная масса эквивалентов вещества В (символ МЭК(В), единица измерения – г/моль) – это отношение массы вещества В(mB) к количеству вещества эквивалентов В(nэк(B)): MЭК(В)=mB/nЭК(B).
Так как nэк(B)=ZB×nВ, то Mэк(B)=MB/ZВ.
Молярная масса эквивалентов вещества В в конкретной химической реакции всегда в ZB раз меньше молярной массы этого же вещества.
Для решения практических задач в химии молярные массы эквивалентов можно рассчитывать по следующим формулам:
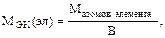 В – валентность.
В – валентность.
Если молекула простого вещества состоит из n атомов, то 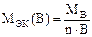 .
.
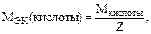 Z – основность кислоты;
Z – основность кислоты;
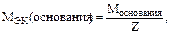 Z – кислотность основания;
Z – кислотность основания;
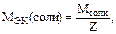 Z=n×B (n – число атомов металла, В – его валентность);
Z=n×B (n – число атомов металла, В – его валентность);
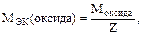 Z=n×B (n – число атомов элемента, В – его валентность).
Z=n×B (n – число атомов элемента, В – его валентность).
Примеры решения задач
Пример 1. Выразите в молях: а) 6,02×1021 молекул СО2; б) 1,2×1024 атомов кислорода; в) 2,0.1023.молекул воды. Чему равна молярная масса указанных веществ?
Решение. Моль – это количество вещества, в котором содержится число частиц любого определенного сорта, равное постоянной Авогадро (NА=6,02×1023 моль–1) Отсюда: а) 0,01 моль, б) 2 моль, в) 1/3 моль.
Так как молекулярные массы СО2 и Н2O и атомная масса кислорода соответственно равны 44,18,16 а.е.м., то их молярные массы равны:
а) 44 г/моль; б) 18 г/моль; в) 16 г/моль.
Пример 2. На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода (н.у.) Вычислите молярную массу эквивалентов металла. Чему равна молярная масса металла?
Решение. Согласно закону эквивалентов массы (объемы, для газов) реагирующих друг с другом веществ m1(V1) и m2(V2) пропорциональны молярным массам их эквивалентов Мэк1 и Мэк2 (молярным объемам их эквивалентов Vэк1 и Vэк2)
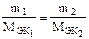 или
или 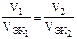 .
.
Объем, занимаемый при данных условиях молярной массой или молярной массой эквивалентов газообразного вещества, называется молярным или, соответственно, молярным объемом эквивалентов этого вещества. Молярный объем любого газа при н.у. Vn =22,4 л×моль–1. Отсюда молярный объем эквивалентов водорода VЭК,(Н2),молекула которого состоит из двух атомов, равен 22,4/ZB =22,4/2= =11,2 л×моль–1, где ZB – эквивалентное число вещества. Таким образом,
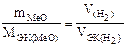 .
.
Из последнего уравнения находим молярную массу эквивалентов оксида металла МЭК(МеО):
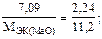
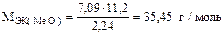 .
.
Молярная масса эквивалентов химического соединения равна сумме молярных масс эквивалентов составляющих его частей.
Отсюда МЭК(Ме)=МЭК(МеО) – МЭК(О2) =35,45–8=27,45 г/моль.
Молярная масса металла определяется из соотношения МЭК=М/Z, где М – молярная масса металла, Z=B(стехиометрическая валентность металла); М=27,45×2=54,9 г/моль.
Пример 3. Вычислите молярные массы эквивалентов H2SO4 и Al(OH)3в реакциях, выраженных уравнениями:
Н2SO4+КОН=КНSO4+H2O; (1)
Al(OH)3+2HCl=Al(OH)Cl2+2H2O; (2)
Al(OH)3+3HNO3=Al(NO3)3+3H2O. (3)
Решение. В обменных реакциях эквивалентное число вещества ZB определяют по стехиометрии реакции. Если в реакции
nA×A+nB×B=nC×C+nd×D
на 1 Ф.Е. (формульная единица) вещества А требуется nB/nA вещества В, то ZA=nB/nA.
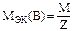 .
.
Следовательно,
МЭК(Н2SO4) = 98/1 = 98 г/моль в уравнении (1);
МЭК[Al(OH)3]=78/2=39 г/моль в уравнении (2);
МЭК [Al(OH)3]=78/3=26 г/моль в уравнении (3).
Пример 4. Из 3,85 г нитрата металла получено 1,6 г его гидроксида. Вычислите молярную массу эквивалентов металла.
Решение. Учитывая пример 2,
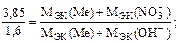
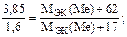
МЭК(Ме)=15 г/моль.
Пример 5. В какой массе Са(ОН)2 содержится такое же количество вещества эквивалентов, сколько в 312 г Al(OH)3?
Решение. МЭК[Al(OH)3]=M/Z=78/3 г/моль. Следовательно, количество вещества эквивалентов Al(ОH)3
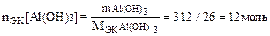 ;
;
Мэк[Ca(OH)2]=74/2=37 г/моль. Отсюда
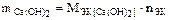 =37 г/моль×12 моль=444 г.
=37 г/моль×12 моль=444 г.
Пример 6. Вычислите абсолютную массу молекулы серной кислоты в граммах.
Решение. Моль любого вещества (см.пример 1) содержит постоянную Авогадро NA структурных единиц (в нашем примере молекул) (табл.П1).
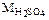 = 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02×1023)= = 1,63× 10–22 г.
= 98,0 г/моль. Следовательно, масса одной молекулы 98/(6,02×1023)= = 1,63× 10–22 г.
Контрольные вопросы
1. В какой массе Na0H содержится такое же количество вещества эквивалентов, сколько в 140 г КОН? Ответ: 100 г.
2. Из 1,35 г оксида металла получается 3,15 г его нитрата. Вычислите молярную массу эквивалентов этого металла. Ответ: 32,5 г/моль.
3. Из 1,3 г гидроксида металла получается 2,85 г его сульфата. Вычислите молярную массу эквивалентов этого металла. Ответ: 9 г/моль.
4. Оксид трехвалентного элемента содержит 31,58% кислорода. Вычислите молярную массу эквивалентов и молярную массу этого элемента. Ответ: 17,3 г/моль; 52 г/моль.
5. Чему равен при н.у. объем эквивалентов водорода? Вычислите молярную массу эквивалентов металла, если на восстановление 1,017 г его оксида израсходовалось 0,28 л водорода (н.у.). Ответ: 11,2 л/моль; 32,68 г/моль.
6. Выразите в молях: а) 6,02×1022 молекул С2Н2; б) 1,8×1024 атомов азота; в) 3,01×1023 молекул NH3. Какова молярная масса указанных веществ?
7. Вычислите молярную массу эквивалентов Н3РО4 в реакциях образования: а) гидрофосфата; б) дигидрофосфата; в) ортофосфата.
8. В 2,48 г оксида одновалентного металла содержится 1,84 г металла. Вычислите молярную массу эквивалентов металла и его оксида. Чему равна молярная масса этого металла. Ответ: 23 г/моль; 31 г/моль; 23 г/моль.
9. Чему равен при н.у. объем эквивалентов кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалентов металла и его молярную массу. Ответ: 5,6 л/моль; 12,17 г/моль; 24,34 г/моль.
10. Из 3,31 г нитрата металла получается 2,78 г его хлорида. Вычислите молярную массу эквивалентов этого металла. Ответ: 103,6 г/моль.
11. Напишите уравнения реакций Fe(OH)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза;
в) трихлорид железа. Вычислите молярные массы эквивалентов Fe(OH)3 в каждой реакции.
12. Избытком гидроксида калия подействовали на растворы:
а) дигидрофосфата калия; б) нитрата дигидроксовисмута (III). Напишите уравнения реакций этих веществ с КОН и определите их молярные массы эквивалентов.
13. В какой массе Cr(OH)3 содержится такое же количество вещества эквивалентов, сколько в 174,96 г Мg(OH)2? Ответ: 206 г.
14. Избытком хлорводородной (соляной) кислоты подействовали на растворы: а) гидрокарбоната кальция; б) дихлорида гидроксоалюминия. Напишите уравнения реакций этих веществ с НСl и определите их молярные массы эквивалентов.
15. При окислении 16,74 г двухвалентного металла образовалось 21,54 г оксида. Вычислите молярные массы эквивалентов металла и его оксида. Чему равна молярная масса металла? Ответ: 27,9 г/моль; 35,9 г/моль; 55,8 г/моль.
16. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л водорода (н.у.). Вычислите молярную массу эквивалентов и молярную массу металла. Ответ: 9 г/моль; 27 г/моль.
17. Исходя из молярной массы углерода и воды, определите абсолютную массу атома углерода и молекулы воды. Ответ: 2×10–23 г;
3×10–23 г.
18. На нейтрализацию 9,797 г ортофосфорной кислоты израсходовано 7,998 г NaOH. Вычислите молярную массу эквивалентов и основность Н3РО4 в этой реакции. На основании расчета напишите уравнение реакции. Ответ: 49 г/моль; 2.
19. На нейтрализацию 0,943 г фосфористой кислоты Н3РО3 израсходовано 1,291 г КОН. Вычислите молярную массу эквивалентов и основность кислоты. На основании расчета напишите уравнение реакции. Ответ: 41 г/моль; 2.
20. Вычислите абсолютную массу молекулы СО2. Ответ:
7,31×10–23 г.
21. В какой массе Н2О содержится 1024 молекул? Ответ: 30 г.
22. Сопоставьте число молекул, содержащихся в 1 г Н2SO4 с числом молекул, содержащихся в 1 г НNO3. В каком случае и во сколько раз число молекул больше?
23. Масса 2,24 л газа (н.у.) равна 2,8 г. Чему равна молярная масса газа? Ответ: 28 г/моль.
24. Молярная масса эквивалентов металла составляет 56 г/моль. Вычислите процентное содержание металла в его кислородном соединении. Ответ: 87,5 %.
25. При сгорании 5 г металла образуется 9,44 г оксида металла. Вычислите молярные массы эквивалентов металла и его оксида.
Ответ: 9 г/моль; 17 г/моль.
 2015-05-14
2015-05-14 1990
1990








