Д.И. МЕНДЕЛЕЕВА
Контрольные вопросы
26. Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
27. Какое максимальное число электронов могут содержать s-, p-, d- и f- орбитали данного энергетического уровня? Почему? Напишите электронную формулу атома элемента с порядковым номером 31.
28. Какие орбитали атома заполняются электронами раньше: 4s или 3d; 5s или 4р? Почему? Напишите электронную формулу атома элемента с порядковым номером 21.
29. Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы?
30. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента?
31. Напишите электронные формулы атомов элементов с порядковыми номерами 15 и 28. Чему равен максимальный спин р-электронов у атомов первого и d-электронов у атомов второго элемента?
32. Сколько и какие значения может принимать магнитное квантовое число ml при орбитальном числе l=0,1,2 и 3? Какие элементы в периодической системе называют s-,p-,d- и f- элементами? Приведите примеры.
33. Какие из электронных формул, отражающих строение невозбужденного атома некоторого элемента неверны: а) 1s22s22p53s1;
б) 1s22s22p6; в) 1s22s22p63s23p64s2; г) 1s22s22p63s23d2? Почему? Атомам каких элементов отвечают правильно составленные электронные формулы?
34. Напишите электронные формулы атомов элементов с порядковыми номерами 24 и 33, учитывая, что у первого происходит “провал” одного 4s-электрона на 3d-подуровень. Чему равен максимальный спин d-электронов у атомов первого и р-электронов у атомов второго элемента?
35. В чем заключается принцип Паули? Может ли быть на каком-нибудь подуровне атома р7- или d12 электронов? Почему? Составьте электронную формулу атома элемента с порядковым номером 22 и укажите его валентные электроны.
36. Дайте определение атомным орбиталям. Как они обозначаются? Сколько атомных орбиталей может быть на третьем и четвертом энергетическом уровне?
37. Составьте электронные формулы атомов азота и серы. Сколько неспаренных электронов имеет каждый из этих атомов?
38. Квантовые числа электронов внешнего энергетического уровня атомов некоторого элемента имеют следующие значения: n=3; l=1; ml=1,0,-1; 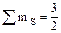 . Напишите электронную формулу этого элемента.
. Напишите электронную формулу этого элемента.
39. В чем заключается правило Хунда? Напишите электронную формулу атома элемента с порядковым номером 15 и распределите электроны по энергетическим ячейкам.
40. В чем заключается правило Клечковского? Составьте электронную формулу атома элемента с порядковым номером 25 и распределите электроны по энергетическим ячейкам.
41. Структура валентного электронного слоя атомов некоторых элементов выражается формулой: а) 5s2; 5р4; б) 3d54s1. Определите порядковый номер и название этих элементов.
42. Среди приведенных ниже электронных конфигураций укажите невозможные, а также укажите причину невозможности их реализации: а)1р3 б) 3р6 в) 3s2 г) 2s2 д) 2d5 е) 5d2 ж) 2р4 з) 3р7.
43. Что такое энергия ионизации? В каких единицах она выражается? Как изменяется восстановительная активность s- и р-элементов в группах периодической системы с увеличением порядкового номера? Почему?
44. Что такое электроотрицательность? Как изменяется электроотрицательность р-элементов в периоде, в группе периодической системы с увеличением порядкового номера? Почему?
45. Что такое сродство к электрону? В каких единицах оно выражается? Как изменяется окислительная активность неметаллов в периоде и в группе периодической системы с увеличением порядкового номера? Ответ мотивируйте строением атома соответствующего элемента.
46. Составьте формулы оксидов и гидроксидов элементов третьего периода периодической системы, отвечающих их высшей степени окисления. Как изменяется кислотно-основной характер этих соединений при переходе от натрия к хлору? Напишите уравнения реакций, доказывающих амфотерность гидроксида алюминия.
47. Какую низшую степень окисления проявляют хлор, сера, азот и углерод? Почему? Составьте формулы соединений алюминия с данными элементами в этой степени окисления. Как называются соответствующие соединения?
48. Какую низшую степень окисления проявляют водород, фтор, сера и азот? Почему? Составьте формулы соединений кальция с данными элементами в этой их степени окисления. Как называются соответствующие соединения?
49. Атомные массы элементов в периодической системе непрерывно увеличиваются, тогда как свойства простых тел изменяются периодически. Чем это можно объяснить? Дайте мотивированный ответ.
50. По какому принципу элементы объединяются в группы и подгруппы?
 2015-05-14
2015-05-14 1368
1368
