Лабораторная работа N 13
Определение отношения теплоёмкости воздуха при постоянном давлении к его теплоёмкости при постоянном объёме методом Клемана и Дезона
Цель работы: изучение изопроцессов, теории теплоёмкости идеального газа и определение постоянной адиабаты: g = 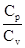 для воздуха.
для воздуха.
Приборы и принадлежности: стеклянный баллон, открытый манометр, насос.
Теоретические сведения
Состояние газа может быть охарактеризовано параметрами:(P,V,T,m, 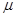 )
)
Где Р – давление газа:
V –объём газа,
Т – абсолютная температура,
m – масса газа, 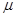 - молярная масса
- молярная масса
PV = 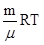
 - уравнение состояния идеального газа, уравнение Клапейрона – Менделеева.
- уравнение состояния идеального газа, уравнение Клапейрона – Менделеева.
Совокупность кинетической энергии хаотического движения молекул и потенциальной энергии их взаимодействия называется внутренней энергией. Внутреннюю энергию системы можно изменить совершив над системой механическую работу.
Возможно внешнее воздействие, при котором изменение внутренней энергии происходит на молекулярном уровне, без совершения механической работы. Количественной мерой изменения внутренней энергии при таком способе, называемом теплопередачей, является количество теплоты 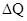 .
.
Закон сохранения энергии или первый закон термодинамики можно записать в следующем виде dU + 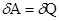 Количество теплоты
Количество теплоты 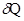 , сообщённое системе, идёт на изменение внутренней энергии системы dU и работу
, сообщённое системе, идёт на изменение внутренней энергии системы dU и работу 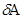 системы над внешними телами. При переходе газа из состояния (1) в состояние (2), работа расширения газа
системы над внешними телами. При переходе газа из состояния (1) в состояние (2), работа расширения газа 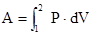 .Внутренняя энергия системы является однозначной функцией состояния, поэтому изменение внутренней энергии системы является полным дифференциалом, что отражено обозначением dU.
.Внутренняя энергия системы является однозначной функцией состояния, поэтому изменение внутренней энергии системы является полным дифференциалом, что отражено обозначением dU.
Переход системы их состояния (1) в состояние (2) может быть осуществлён разными способами. Поэтому 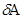 зависит от способа перехода системы из состояния (1) в состояние (2). Поскольку dU не зависит, а
зависит от способа перехода системы из состояния (1) в состояние (2). Поскольку dU не зависит, а 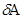 зависит от способа перехода, то и dQ зависит от способа перехода системы из одного состояния в другое.
зависит от способа перехода, то и dQ зависит от способа перехода системы из одного состояния в другое.
Поэтому сообщенная система теплота 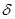 Q и произведённая системой работа не являются полными дифференциалами, а являются функционалами, т.к. они зависят от вида функции, описывающей переход системы из одного состояния в другое.
Q и произведённая системой работа не являются полными дифференциалами, а являются функционалами, т.к. они зависят от вида функции, описывающей переход системы из одного состояния в другое.
Теплоёмкостью C называется величина равная отношению сообщённого системе количества теплоты 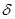 Q к вызванному этим процессом повышению температуры dT. Для сравнения теплоёмкостей различных веществ различают удельную теплоёмкость с=
Q к вызванному этим процессом повышению температуры dT. Для сравнения теплоёмкостей различных веществ различают удельную теплоёмкость с= 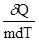 т.е. количество теплоты необходимое для нагревания одного кг вещества на один кельвин, и молярную теплоёмкость.
т.е. количество теплоты необходимое для нагревания одного кг вещества на один кельвин, и молярную теплоёмкость.
С = 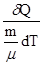 - количество теплоты, необходимое для нагревания одного моля вещества на один кельвин.
- количество теплоты, необходимое для нагревания одного моля вещества на один кельвин.
Используя первый закон термодинамики, запишем молярную теплоёмкость для одного моля (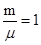 )
)
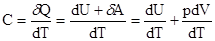
Из этой формулы видно, что теплоёмкость зависит от изменения внутренней энергии и от изменения второй переменной, например, объёма.
Для газов, у которых объём сильно меняется с температурой, пренебрегать зависимостью теплоёмкости от объёма нельзя.
Рассмотрим нагревания газа при постоянном объёме (изохорический процесс). Т.к. dV=0 то 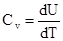
Где Cv- мольная теплоёмкость при постоянном объёме.
Для идеального газа будем считать её постоянной величиной, не зависящей от температуры. Тогда 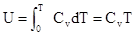 - это означает, что внутренняя энергия идеального газа зависит только от абсолютной температуры.
- это означает, что внутренняя энергия идеального газа зависит только от абсолютной температуры.
Для изобарического процесса. (р = const)
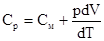
Из уравнения Клапейрона – Менделеева рdV = 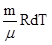 т.к. у нас
т.к. у нас 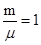 , то
, то
РdV = RdT Тогда 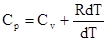
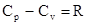 - уравнение Майера.
- уравнение Майера.
В зависимости от условий нагревания и расширения теплоёмкость может принимать значения не только равные 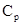 и
и 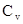 но и всевозможные другие.
но и всевозможные другие.
Так при адиабатических процессах, когда нет теплообмена между системой и окружающей средой, 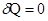 , следовательно,
, следовательно, 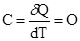 .
.
Первый закон термодинамики для адиабатического процесса будет иметь вид: dU + dA = 0. 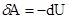 адиабатическое расширение или -
адиабатическое расширение или - 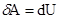 (адиабатическое сжатие)
(адиабатическое сжатие)
При изотермическом процессе расширения газ совершает работу только за счёт подводимого тепла, т.к. внутренняя энергия во время такого процесса не меняется. Следовательно, 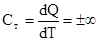 .
.
Классическая теория теплоёмкости разработана Больцманом и Максвеллом. Эта теория основывается на представлении о равномерном распределении энергии по степеням свободы движения молекул. Числом степеней свободы называется число движений не ограниченных связями. Для идеального газа кинетическая энергия поступательного движения молекул, очевидно, равна его внутренней энергии 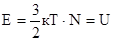 к – постоянная Больцмана
к – постоянная Больцмана
Для одного моля U= 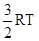 . R=NA к R – универсальная газовая постоянная.
. R=NA к R – универсальная газовая постоянная.
Молекула одноатомного газа имеет три степени свободы движения относительно трёх осей координат
Обозначим число степеней свободы через i. Тогда для одноатомного газа i. =3 В общем случае для многоатомного идеального газа 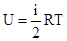 - внутренняя энергия одного моля идеального газа.
- внутренняя энергия одного моля идеального газа.
Вычислим мольные теплоёмкости (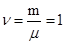 )
)
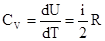
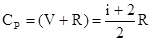
Тогда 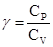 - называется коэффициентом адиабаты или коэффициент Пуассона
- называется коэффициентом адиабаты или коэффициент Пуассона 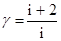 .
.
 2015-05-14
2015-05-14 523
523







