ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
УРОВЕНЬ B
1. а) Назвать следующие химические соединения и определить степень окисления всех элементов соединений: СО, Mn(OH)2, H2SO4, KHS, Na2CO3, FeOH(NO3)2.
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Ответ:
а) С+2О-2 – оксид углерода (II),
Mn+2 (O-2H+1)2 – гидроксид марганца (II),
Н+12S+4O-23 – сернистая кислота,
К+1Н+1S-2 – гидросульфид калия,
Na2+1С+4О-23 – карбонат натрия,
Fe+3O-2H+1(N+5O-23)2 – нитрат гидроксожелеза (III).
б) оксид свинца (IV) – PbO2,
сульфат лития – Li2SO4,
хлорид гидроксоцинка – ZnOHCl;
дигидроортофосфат алюминия – Al(H2PO4)3.
2. ЭКВИВАЛЕНТ. ЗАКОН ЭКВИВАЛЕНТОВ
УРОВЕНЬ В
1. Трехвалентный элемент образует оксид, содержащий 68,90 % мас. кислорода. Вычислить молярную массу эквивалента элемента и назвать элемент.
Дано: 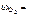 68,90 % мас. В = 3 68,90 % мас. В = 3 | Решение Чтобы назвать элемент, необходимо вычислить молярную массу атома элемента (М э). М э = М эк(Э)·В, |
| М эк(Э) –? Э –? |
где Мэк(Э)·– молярная масса эквивалента элемента;
В – валентность элемента.
По закону эквивалентов n эк(Э) = n эк(О), т.е.
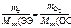 ,
,
откуда Мэк (Э) = 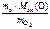 .
.
М эк(О) = 8 г/моль.
m окс = m э + 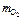 ;
; 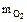 = 68,9 г.
= 68,9 г.
m э = 100 – 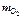 = 100 – 68,9 = 31,1 г.
= 100 – 68,9 = 31,1 г.
М эк(Э) = 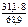 = 3,61 г/моль
= 3,61 г/моль
М эк(Э) = 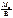 ,
,
М э = М эк(Э) ∙ В = 3,61∙3 = 10,83 г/моль, что соответствует молекулярной массе атома бора.
Ответ: М эк(Э) = 3,61 г/моль; элемент – В.
2. На восстановление 7,2 г оксида потребовалось 2,24 л водорода, измеренного при н.у. Рассчитать молярные массы эквивалентов оксида и металла.
Дано: m окс. = 7,2 г 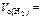 2,24 л 2,24 л | Решение По закону эквивалентов nэк(окс) = nэк(H2),  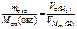 , , |
| М эк(окс.) –? М эк(Ме) –? |
где 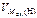 = 11,2 л/моль.
= 11,2 л/моль.
М эк(окс) = 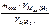 =
= 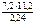 = 36 г/моль;
= 36 г/моль;
М эк(окс) = М эк(Ме) + М эк(О);
М эк(Ме) = М эк(окс) – М эк(О) = 36 – 8 = 28 г/моль.
Ответ: М эк(окс) = 36 г/моль;
М эк(Ме) = 28 г/моль.
3. Хлорид некоторого металла (MeClх) массой 0,493 г обработали избытком раствора AgNO3. При этом образовалось 0,86 г AgCl. Вычислить молярную массу эквивалента металла.
Дано: 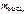 = 0,493 г = 0,493 г 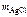 = 0,86 г = 0,86 г | Решение По закону эквивалентов nэк(МеCl х) = = nэк(AgCl) т.е. 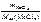 = = 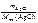 ; ; |
| M эк(Me) –? |
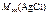 =
= 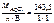 143,5 г/моль.
143,5 г/моль.
где 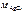 – молярная масса AgCl;
– молярная масса AgCl;
В – валентность серебра;
n – число атомов серебра в молекуле соли.
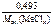 =
= 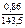 ,
,
откуда 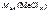 =
= 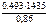 = 82,3 г/моль.
= 82,3 г/моль.
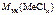 =
= 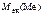 +
+ 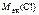 ;
;
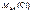
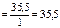 г/моль.
г/моль.
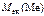 =
= 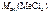 –
– 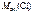 ,
,
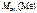 = 82,3 –35,5 = 46,8 г/моль.
= 82,3 –35,5 = 46,8 г/моль.
Ответ: 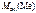 = 46,8 г/моль.
= 46,8 г/моль.
 2015-05-10
2015-05-10 3506
3506