1. Вычислить температуры кипения и замерзания водного раствора, содержащего 0,1 моль сахарозы (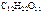 ) в 500 г раствора.
) в 500 г раствора.
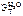 = 0,52 кг·К/моль,
= 0,52 кг·К/моль, 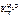 = 1,86 кг·К/моль.
= 1,86 кг·К/моль.
Дано:  = 0,1 моль m р-ра = 500 г = 0,1 моль m р-ра = 500 г 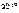 = 0,52 кг·к/моль = 0,52 кг·к/моль 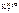 = 1,86 = 1,86 | Решение t кип р-ра = 100 ºС + ∆ t кип, t зам р-ра = 0 ºС – ∆ t зам , ∆tкип = 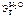 · cm ( · cm (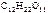 ), ∆tзам = ), ∆tзам = 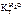 · cm ( · cm (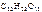 ), cm ( ), cm (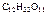 ) – моляльность сахарозы в растворе, моль/кг. ) – моляльность сахарозы в растворе, моль/кг. |
| t кип р-ра –? t зам р-ра –? |
cm (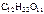 ) =
) = 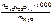 ,
,
где 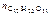 – количество растворенной сахарозы,
– количество растворенной сахарозы,
Моль.
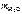 =
= 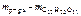 , г;
, г;
cm (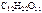 )
) 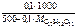
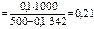 моль/кг,
моль/кг,
где М 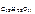 = 342 г/моль
= 342 г/моль
∆ t кип = 0,52 ∙ 0,21 = 0,109 ºС;
t кип р-ра = 100 ºС + 0,109 ºС = 100,109 ºС;
∆ t зам = 1,86∙0,21 = 0,391 ºС;
t зам р-ра = 0 ºС – 0,391 ºС = –0,391 ºС.
Ответ: t кип р-ра = 100,109 ºС;
t зам р-ра = – 0,391 ºС.
2. В 100 г воды содержится 2,3 г неэлектролита. Раствор обладает при 25 ºС осмотическим давлением, равным 618,5 кПа. Определить молярную массу неэлектролита. Плотность раствора принять равной 1 г/см3.
Дано: m в = 2,3 г t = 250C 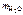 = 100 г π = 618,5 кПа ρр-ра = 1 г/см3 = 100 г π = 618,5 кПа ρр-ра = 1 г/см3 | Решение π = с в ∙ R ∙ T, кПа. R = 8,314 л∙кПа/(моль∙К). с в – молярная концентрация вещества, моль/л. V р-ра = m р-ра/ρр-ра = (m B + m 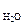 )/ρр-ра , см3. V р-ра = )/ρр-ра , см3. V р-ра = 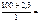 102,3 см3 = 0,102 л. 102,3 см3 = 0,102 л. |
| М В –? |
с в = 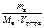 , моль/л,
, моль/л,
где m в – масса растворенного неэлектролита, г;
М в – молярная масса растворенного неэлектролита, г/моль.
π = 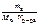 ∙ R ∙ T, кПа;
∙ R ∙ T, кПа;
М в = 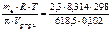 = 90,33 г/моль.
= 90,33 г/моль.
 2015-05-10
2015-05-10 1170
1170








