1. Вычислить рН следующих водных растворов:
А) 0,02 М HCl,
Б) 0,2 М KOH.
| Дано: c HCl = 0,02 М c KOH = 0,2 М | Решение а) HCl = H+ + Cl- рН = -lg c 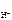 ; ; |
| pH –? |
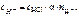
HCl – сильный электролит, α = 1,
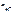 – число Н+, образовавшихся при диссоциации одной молекулы НСl,
– число Н+, образовавшихся при диссоциации одной молекулы НСl,
n 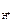 = 1, тогда
= 1, тогда 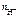 = c
= c 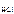 = 0,02 моль/л = 2 · 10-2 моль/л.
= 0,02 моль/л = 2 · 10-2 моль/л.
рН = -lg2·10-2 = -lg2 + (-lg10-2)= – 0,3 + 2 = 1,7.
б) KOH = К+ + ОН-;
рН = 14 – рОН; рОН = -lg c 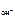 ,
,
c 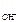 = c
= c 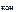 · α · n
· α · n 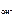 ,
,
КОН – сильный электролит, α = 1,
n 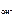 – число ОН-, образовавшихся при диссоциации одной молекулы КОН, n
– число ОН-, образовавшихся при диссоциации одной молекулы КОН, n 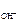 = 1, тогда c
= 1, тогда c 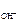 = c KOH = 2·10-1 моль/л,
= c KOH = 2·10-1 моль/л,
рОН = –lg(2·10-1) = –lg2 + (–lg10-1) = – 0,3 + 1 = 0,7.
рН = 14 – 0,7 = 13,3.
Ответ: рН 0,02 М HCl равно 1,7;
РН 0,2 М КОН равно 13,3.
Вычислить рН 0,05 М водного раствора хлорноватистой кислоты (HOCl).
Дано: c 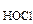 = 0,05 М = 0,05 М | Решение HOCl <=> H+ + OCl- HOCl – слабый электролит. рН = –lg[H+]; [H+] = c НOСl·α· n 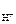 , , |
| pH –? |
n 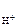 – число Н+ образовавшихся при диссоциации одной молекулы HOCl, n
– число Н+ образовавшихся при диссоциации одной молекулы HOCl, n 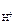 = 1.
= 1.
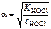 ;
;
КHOCl – константа диссоциации HOCl:
К 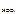 = 5,0·10-8 (таблица),
= 5,0·10-8 (таблица),
Тогда
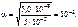
c 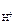 = 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
= 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
тогда рН = – lg5,0·10-5 = (-lg 5) + (-lg10-5) = – 0,7 + 5 = 4,3.
 2015-05-10
2015-05-10 1524
1524








