3. Определить произведение растворимости MgF2, если его растворимость в воде при 25 ºС равна 1,17·10-3 моль/л.
Дано:
c 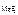 = 1,17·10-3 моль/л = 1,17·10-3 моль/л
| Решение Равновесие между осадком малорастворимого электролита и насыщенным раствором над ним выражается уравнением |
ПР 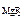 –? –?
|
MgF2(к) <=> Mg2+ (р) + 2F-(р),
ПР 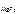 = [Mg2+ ]·[F-]2,
= [Mg2+ ]·[F-]2,
[Mg2+ ] = c 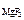 ·α· n
·α· n 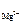 , [F-] = c
, [F-] = c 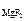 ·α· n
·α· n 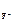 .
.
MgF2 – сильный электролит, α = 1;
n 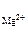 = 1, n
= 1, n 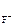 = 2 (из приведенного уравнения)
= 2 (из приведенного уравнения)
[Mg2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л;
[F-] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР 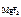 = 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
Ответ: ПР 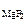 = 6,41·10-9.
= 6,41·10-9.
8. ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ B
1.Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
А) сульфата хрома (III),
Б) сульфида натрия
 2015-05-10
2015-05-10 453
453








