1.а) Алюминиевый электрод погружен в 5∙10-4 М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
Дано:
Металл – Al
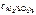 = 5∙10-4 моль/л = 5∙10-4 моль/л
| Решение
Электродный потенциал алюминия рассчитываем по уравнению Нернста:
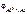 = = 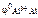 + + 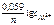
|
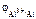 –? –?
|
По табл. 11.1 определяем стандартный электродный потенциал алюминия:
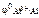 = –1,67 В.
= –1,67 В.
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе соли:
Al – 3ē = Al3+.
n – число электронов, участвующих в электродном процессе.
Для данной реакции n равно заряду иона алюминия Al3+(n = 3). Рассчитываем концентрацию ионов алюминия в растворе Al2(SO4)3:
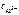 =
= 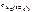 ∙ α ∙
∙ α ∙ 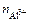 .
.
Разбавленный раствор Al2(SO4)3 – сильный электролит.
Следовательно, α = 1. По уравнению диссоциации Al2(SO4)3.
Al2(SO4)3 = 2Al3+ + 3SO 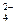
число ионов Al3+, образующихся при диссоциации одной молекулы Al2(SO4)3, равно 2.
Следовательно, 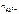 = 2.
= 2.
Тогда 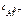 = 5∙10-4∙1∙2 =
= 5∙10-4∙1∙2 = 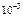 моль/л.
моль/л.
Рассчитываем электродный потенциал алюминиевого электрода:
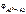 = -1,67 +
= -1,67 + 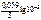 = –1,73 В.
= –1,73 В.
Ответ: 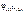 = –1,73 В.
= –1,73 В.
|
|
|
 2015-05-10
2015-05-10 427
427








