По табл. 11.1 находим значение стандартных электродных потенциалов железа (II) и цинка:
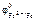 = – 0,44В,
= – 0,44В, 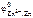 = – 0,76В.
= – 0,76В.
Так как 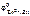 <
< 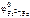 , то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
, то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
а) Коррозия в атмосферных условиях (H2O + O2).
Составляем схему коррозионного ГЭ:
А(-)Zn H2O + O2 Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 2
На К(+) 2H2O + O2 + 4ē = 4OH- 1
2Zn + 2H2O + O2 = 2Zn(OH)2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде (H2SO4).
Составляем схему коррозионного ГЭ:
А(-)Zn │ H2SO4 │ Fe(+)K
Или
А(-)Zn │ H+ │ Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 1
На К(+) 2H+ + 2ē = H2 1
Zn + 2H+ = Zn2+ + H2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Zn + H2SO4 = ZnSO4 + H2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода (HCl + O2).
Составляем схему коррозионного ГЭ:
А(-)Zn │ HCl + O2 │ Fe(+)K
Или
А(-)Zn │ H+ + O2 │ Fe(+)K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A(-) Zn – 2ē = Zn2+ 2
На К(+) 4H+ + O2 + 4ē = 2H2O 1
2Zn + 4H+ + O2 = 2Zn2+ + 2H2O – суммарное ионно-молекулярное уравнение процесса коррозии.
2Zn + 4HCl + O2 = 2ZnCl2 + 2H2O – суммарное молекулярное уравнение процесса коррозии.
 2015-05-10
2015-05-10 712
712








