ЭЛЕКТРОЛИЗ РАСТВОРОВ
УРОВЕНЬ В
Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди (II); б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| Дано: а) CuCl2, б) NaОН. Анод инертный | Решение а) CuCl2 = Cu2+ + 2Cl-. Схему электролиза составляем в соответствии с табл. 11.1 и 11.2: K(-) A(+) инертный Cu2+ + 2ē = Cu 2Cl- – 2ē = Cl2 H2O H2O |
| 1. Схема электролиза –? 2. Продукты электролиза –? |
На катоде выделяется Cu, на аноде – Cl2.
б) NaОН = Na+ + ОН-.
K(-) A(+) инертный
Na+ 4ОН 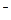 – 4ē = О2 + 2H2О
– 4ē = О2 + 2H2О
2H2O + 2ē = H2 + 2OH-
На катоде выделяется Н2, на аноде – О2.
Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля (II), если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
| Дано: NiSO4 а) анод инертный б) анод никелевый | Решение
а) анод – инертный
NiSO4 = Ni2+ + 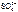 .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2: .
Схему электролиза составляем в соответствии с табл. 11.1. и 11.2:
|
| 1. Схема электролиза –? 2. Продукты электролиза –? |
K(-) A(+) инертный
Ni2+ + 2ē = Ni 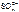
2H2O + 2ē = H2 + 2OH- 2H2O – 4ē = О2 + 4H+.
На катоде выделяется Ni и H2, на аноде выделяется О2.
б) анод – никелевый:
NiSO4 = Ni2+ + 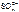
K(-) A(+) (Ni)
Ni2+ + 2ē = Ni 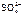 , Н2О
, Н2О
2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+.
На катоде выделяется Ni и H2, на аноде растворяется Ni.
При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
Дано:
Электролиты:
а) Ca(NO3)2
б) AgNO3
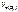 анод = 560 см3
Анод инертный анод = 560 см3
Анод инертный
| Решение
а) Ca(NO3)2 = Ca2+ + 2 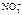 .
Схема электролиза:
K(-) A(+) инертный
Ca2+ .
Схема электролиза:
K(-) A(+) инертный
Ca2+ 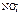 2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
2H2O + 2ē = H2O – 4ē =
= H2 + 2OH- =О2 + 4H+
На катоде выделяется Н2, на аноде выделяется О2.
По закону эквивалентов:
n эк (В1)(анод) = n эк (В2)(катод)
|
1. Схема электролиза
2. 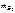 –?
3. –?
3. 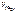 –?
4. –?
4. 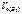 –? –?
|
 2015-05-10
2015-05-10 409
409








