Среди факторов, определяющих возможность и целесообразность практического использования металлов и их сплавов, важнейшим является стоимость. Стоимость, в свою очередь, зависит от распространенности металлов в природе, химической устойчивости, определяющей способ производства, масштаба производства, степени совершенства технологии производства, хозяйственной и политической ситуации.
Основным источником добычи металлов является земная кора — литосфера.
В табл. 2.1 приведены данные о содержании в земной коре на глубине до 1 км металлов, которые являются основой сплавов, применяемых в художественном литье. Для сравнения укажем, что массовая доля кислорода в литосфере составляет 46,6%, кремния — 27,7%, платины — 5-10~8%.
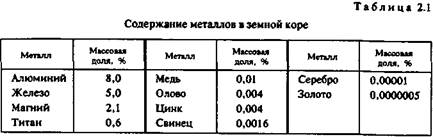
Однако в табл. 2.1 приведены усредненные по всей массе земной коры цифры, в то время как для практических целей важно знать степень рассеянности элементов. Она оценивается числом минералов, в которые входит металл. Чем меньше это число, тем выше степень рассеянности. Объем переработки пустой породы при добыче, а значит, и стоимость металла тем больше, чем меньше он распространен и локализован.
Существует зависимость между числом минералов и распространенностью всех элементов таблицы Менделеева. Зависимость имеет две области — локализованных (А) и рассеянных (Б) элементов. На рис. 2.2 показана та-
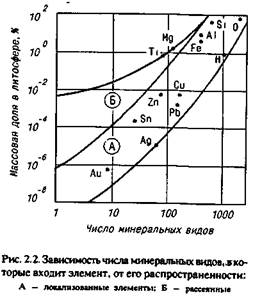
кая зависимость для металлов, которые входят в состав сплавов, используемых в художественном литье, а также (для сравнения) — для кислорода, водорода и кремния.
' Стоимость получения химически чистого металла определяется его химической активностью и может быть оценена по энтальпии его наиболее устойчивого оксида. Энтальпия характеризует изменение внутренней энергии вещества при различных преобразованиях, в том числе при образовании оксида металла, и соответствует энергозатратам, необходимым для его разрушения.
Можно выделить четыре группы способов производства металлов.
Физические способы. Простейшим из них является прямое извлечение из природных источников. Примером может служить добыча самородного золота. Некоторые металлы (платину, мышьяк и др".) получают разложением природных соединений при нагревании. Физические способы — наиболее дешевые. Они приемлемы для металлов и соединений, имеющих очень низкую отрицательную энтальпию.
Восстановление неметаллами. Как правило, реакции восстановления идут при высоких температурах. В качестве восстановителей применяют углерод или оксид углерода (для железа, олова и др.), сернистый газ или сульфиды (для меди, ниобия и др.) или водород (для вольфрама, молибдена, рения и др.). Способ пригоден для получения металлов со сравнительно невысокой энтальпией оксидов и обходится дороже, чем предыдущий.
Электролиз. Электролиз в водных растворах (меди, хрома, висмута и др.) или в расплавах солей (алюминия, магния и др.) применяется для получения химически активных металлов и стоит еще дороже.
Восстановление металлами (металлотермия). Этот способ требует предварительного получения химически чистых металлов — восстановителей. Металл восстанавливают из оксидов (ванадий, барий, галий и др.) или галогенных соединений (титан, цинк, бериллий и др). Это самый дорогой способ.
Общий объем производства металлов изменяется из года в год, но соотношение объемов производства разных металлов остается примерно одинаковым. Так, годовые объемы производства железа (точнее, его сплавов — стали и чугуна) в промышленно развитых странах измеряются миллиардами тонн, алюминия и меди — десятками миллионов, цинка, свинца и хрома — миллионами тонн, никеля, магния и олова — сотнями тысяч тонн, титана, кобальта и кадмия — десятками тысяч тонн,,| золота и ртути — тысячами тонн, платины — сотнями тонн, рения — десятками тонн.
Металлы, так или иначе используемые в художественном литье, можно разделить по стоимости следующим образом:
дешевые — алюминий, железо, магний, медь, свинец, цинк;
недорогие (в 2—10 раз дороже дешевых) — титан, никель, | хром, кадмий, сурьма;
дорогие (в 10—100 раз дороже дешевых) — вольфрам, ванадий, j кобальт, молибден, ниобий, олово, ртуть, цирконий;
дорогостоящие (в 100—1000 раз дороже дешевых) — серебро, бериллий, тантал;
драгоценные (в 1000 — 10 000 раз дороже дешевых) — золото, платина, рений, осмий, иридий.
С течением времени цены на металл меняются под влиянием двух противоположных тенденций — удешевления производства, связанного с техническим прогрессом, и удорожания сырья и энергии вследствие исчерпания доступных запасов.
После распада Советского Союза нарушение экономических связей между регионами поставило ценообразование в прямую зависимость от политических и социально-экономических факторов.
2.1.3. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
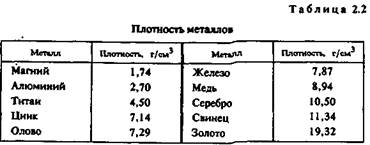
Плотность. Это — одна из важнейших характеристик металлов и сплавов. По плотности металлы делят на следующие группы:
легкие (плотностью не более 5 г/см3) — магний, алюминий, титан и др.;
тяжелые (плотностью от 5 до 10 г/сМ3) — железо, никель, медь, цинк, олово и др. (это наиболее обширная группа);
очень тяжелые (плотностью более 10 г/см3) — молибден, вольфрам, золото, свинец и др.
В табл. 2.2 приведены значения плотности металлов. (Эта и последующие таблицы характеризуют свойства только тех металлов, которые составляют основу сплавов для художественного литья.)
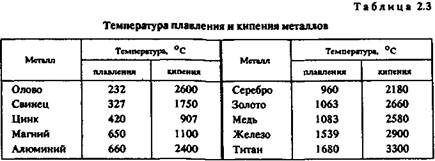
Температура плавления. В зависимости от температуры плавления металлы подразделяются на следующие гр/ппы:
легкоплавкие (температура плавления не превышает 600 °С) — цинк, олово, свинец, висмут и др.;
среднеплавкие (от 600 до 1600 °С) — к ним относится почти половина металлов, в том числе магний, алюминий, железо, никель, медь, золото;
тугоплавкие (более 1600 ° С) — вольфрам, молибден, титан, хром и др.
Ртуть относится к жидкостям.
При изготовлении художественных отливок температура плавления металла (табл. 2.3) или сплава определяет выбор плавильного агрегата и огнеупорного формовочного материала. При введении в металл добавок температура плавления, как правило, понижается.
Удельная теплоемкость. Это количество энергии, необходимое для повышения температуры единицы массы на один градус. Удельная теплоемкость уменьшается с увеличением порядкового номера элемента в таблице Менделеева. Зависимость удельной теплоемкости элемента в твердом состоянии от атомной массы описывается приближенно законом Дюлонга и Пти:
m«Cm = 6,
где nv» — атомная масса; ст — удельная теплоемкость (Дж/кг • °С).
В табл. 2.4 приведены значения удельной теплоемкости некоторых металлов.
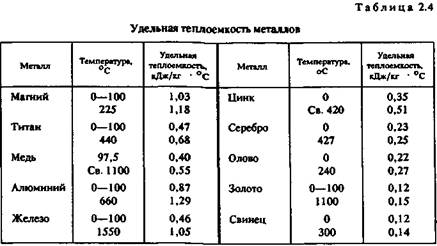
Скрытая теплота плавления металлов. Это характеристика (табл. 2.5) наряду с удельной теплоемкостью металлов в значительной степени определяет необходимую мощность плавильного агрегата Для расплавления легкоплавкого металла иногда требуется больше тепловой энергии, чем для тугоплавкого. Например, для нагревания меди от 20 до 1133 ° С потребуется в полтора раза меньше тепловой энергии, чем для нагревания такого же количества алюминия от 20 до 710 ° С.
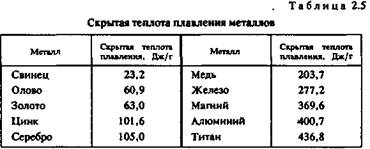
Теплопроводность. Теплопроводность характеризует передачу тепловой энергии от одной части тела к другой, а точнее, молекулярный перенос теплоты в сплошной среде, обусловленный наличием градиента температуры (табл. 2.6)
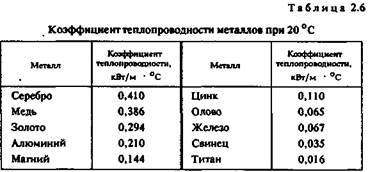
Качество художественного литья тесно связано с теплопроводностью металла. В процессе выплавки важно не только обеспечить достаточно высокую температуру металла, но и добиться равномерного распределения температуры во всем объеме жидкой ванны Чем выше теплопроводность, тем равномернее распределена температура. При электродуговой плавке, несмотря на высокую теплопроводность большинства металлов, перепад температуры по сечению ванны достигает 70—80° С, а для металлов с низкой теплопроводностью этот перепад может достигать 200 ° С и более.
Благоприятные условия для выравнивания температуры создаются при индукционной плавке.
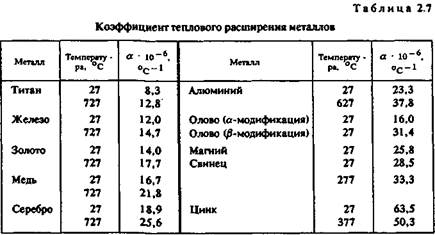
Коэффициент теплового расширения. Эта величина, характеризующая изменение размеров образца длиной 1 м при нагревании на 1 ° С, имеет важное значение при эмальерных работах (табл. 2.7).
Коэффициенты теплового расширения металлической основы и эмали должны иметь по возможности близкие значения, чтобы после обжига эмаль не растрескивалась. Большинство эмалей, представляющих твердый раствор оксидов кремния и других элементов, имеют низкий коэффициент теплового расширения. Как показала практика, эмали очень хорошо держатся на железе, золоте, менее прочно — на меди и серебре. Можно полагать, что титан — весьма подходящий материал для эмалирования.
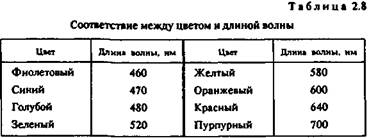
Отражательная способность. Это — способность металла отражать световые волны определенной длины, которая воспринимается человеческим глазом как цвет (табл. 2.8).
Цвета металлов указаны в табл. 2.9.
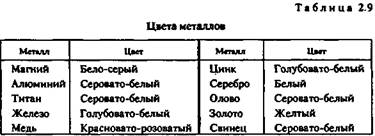
Чистые металлы в декоративно-прикладном искусстве практически не применяются. Для изготовления различных изделий используют сплавы, цветовые характеристики которых значительно отличаются от цвета основного металла.
В течение долгого времени накапливался огромный опыт применения различных литейных сплавов для изготовления украшений, бытовых предметов, скульптур и многих других видов художественного литья. Однако до сих пор еще не раскрыта взаимосвязь между строением сплава и его отражательной способностью.
2.1.4. МЕХАНИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
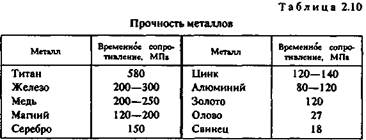
Прочность. Прочностью называют свойство твердых тел сопротивляться разрушению, а также необратимым изменениям формы. Основным показателем прочности является временное сопротивление, определяемое при разрыве цилиндрического образца, предварительно подвергнутого отжигу. По прочности металлы можно разделить на следующие группы:
непрочные (временное сопротивление не превышает 50 МПа) — олово, свинец, висмут, а также мягкие щелочные металлы;
прочные (от 50 до 500 МПа) — магний, алюминий, медь, железо, титан и другие металлы, составляющие основу важнейших конструкционных сплавов;
высокопрочные (более 500 МПа) — молибден, вольфрам, ниобий и др.
К ртути понятие прочности неприменимо, поскольку это жидкость.
Временное сопротивление металлов указано в табл. 2.10.
Пластичность. Пластичность — это свойство твердых тел сохранять часть деформации при снятии нагрузок, которые их вызвали. В качестве показателя пластичности выбрано относительное удлинение, определяемое при тех же испытаниях, что и временное сопротивление.
По степени пластичности металлы принято подразделять следующим образом:
высокопластичные (относительное удлинение превосходит 40 %) — металлы, составляющие основу большинства конструкционных сплавов (алюминий, медь, железо, титан, свинец) и «легкие» металлы (натрий, калий, рубидий и др.);
пластичные (относительное удлинение лежит в диапазоне между 40 и 3%) — магний, цинк, молибден, вольфрам, висмут и др. (наиболее обширная группа);
хрупкие (относительное удлинение меньше 3%) — хром, марганец, кобальт, сурьма.
Высокая очистка хрупких металлов несколько повышает пластичность. Сплавы, полученные на их основе, почти не поддаются обработке давлением. Промышленные изделия из них часто получают путем литья. Относительное удлинение металлов характеризует табл. 2.11.

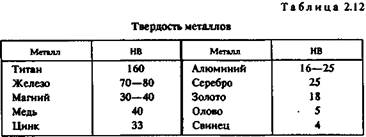
Твердость. Твердость — характеристика материала, отражающая его прочность и пластичность, определяемая путем вдавливания шарика (метод Бринелля) или призмы (метод Виккерса). Количественной оценкой твердости является число твердости НВ, равное отношению нагру-жения (Н) к площади поверхности отпечатка (мм2). Значения твердости металлов по Бринеллю приведены в табл. 2.12.

Модуль продольной упругости. Модуль продольной упругости, или модуль Юнга, Е определяет жесткость металла, т. е. интенсивность увеличения напряжения по мере увеличения упругости деформации (табл. 2.13).
2.1.5. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
Растворимость. Это — способность вещества растворяться в том или ином растворителе. Металлы растворяются в сильных кислотах и едких щелочах.
В промышленном производстве наиболее часто употребляются серная, азотная и соляные кислоты, смесь азотной и соляной кислот (царская водка), а также щелочи — едкий натр и едкое кали.
Растворение может быть частичным, затрагивающим только поверхностные слои, или полным, когда металл полностью переходит в раствор.
Частичное растворение происходит, например, при травлении изделий для получения гладкой поверхности или для нанесения рисунка на изделие/полное — при растворении цинка в соляной кислоте в целях получения флюса для пайки.
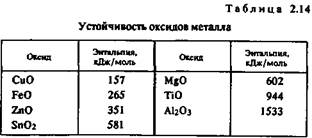
Окисляемость. Она характеризует способность металлов соединяться с кислородом и образовывать оксиды.
Интенсивность окисления металлов пропорциональна энтальпии их оксидов (табл. 2.14). Для сравнения отметим, что энтальпия монооксида углерода СО составляет 111 кДж/моль.
В ряде случаев образование прочной оксидной пленки на поверхности изделия желательно, так как пленка предохраняет металл от дальнейшего окисления. При пайке и сварке алюминиевых сплавов пленка препятствует соприкосновению припоя с чистой поверхностью металла.
Коррозионная стойкость. Это — способность металла сопротивляться разрушению, которое вызвано химическим воздействием окружающей среды.
Чисто химическая коррозия определяется главным образом окислением, электрохимическая коррозия возникает из-за физико-химической неоднородности металлов в присутствии жидкости, способной проводить электрический ток.
Электрохимическая активность металлов характеризуется электродным потенциалом, измеренным относительно водорода (табл. 2.15)
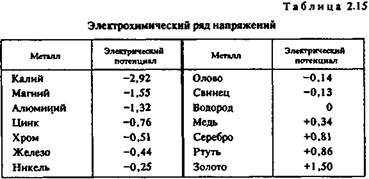
Каждые два металла образуют гальваническую пару. При этом электродвижущая сила будет тем больше, чем дальше друг от друга они стоят в электрохимическом ряду.
Взаимодействие металлов с газами. Качество отливки во многом зависит от взаимодействия металлов (особенно их жидких расплавов) с газами. Это взаимодействие представляет собой комплекс сложных физико-химических процессов, направленных в сторону равновесия.
В реальных условиях полное равновесие между газообразной и жидкой фазами достигается крайне редко. Поэтому термодинамические расчеты, относящиеся к состоянию равновесия, как правило, показывают лишь направление взаимодействия.
Возможны три случая взаимодействия газов с расплавами.
/. Полная взаимная инертность. Она наблюдается, например, при плавлении любых металлов в среде инертных газов (аргонп, гелия и др.).
2. Газ практически нерастворим в металле. Образующиеся химические соединения в виде жидких капель, плен или кристаллов, проникая в металл, загрязняют его.
3. Газы образуют с металлом растворы. Как известно, растворимость в металле двухатомного газа [Г]ме зависит от давления газа рг и от температуры Т:
[Лм. = *Vp7 exp[—ДО/(ЯГ)1,
где k — постоянный коэффициент, R — газовая постоянная; АО — теплота растворения 1 моля газа в расплаве.
Значение ДО может быть положительным и отрицательным.
При ДО > О процесс растворения газа сопряжен с поглощением теплоты и является эндотермическим. В этом случае повышение температуры вызывает увеличение содержания газа в металле (рис. 2.3, кривая 1).
При ДО < 0 растворение газа сопровождается выделением теплоты, т. е. является экзотермическим процессом, и повышение температуры вызывает снижение содержания газов в растворе (рис. 2.3, кривая 2).
При эндотермическом процессе, когда растворимость,газа снижается по мере охлаждения
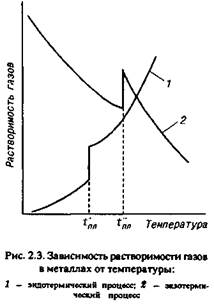
расплавов, в ходе кристаллизации
в отливке могут образовываться
газовые пузыри. Это происходит
из-за избыточного для низких температур количества газа в расплаве.
Эти пузыри являются причиной образования газовой пористости.
В табл. 2.16 приведены данные о взаимодействии жидких металлов с различными газами (водородом, кислородом, азотом). В таблицу также включены сведения об углероде, поскольку надо учитывать возможность растворения монооксида углерода. Знак «+» указывает на существенную растворимость, знак «—» указывает на незначительную растворимость.
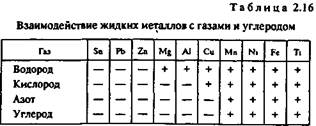
Взаимодействие с водородом. Водород составляет основную долю растворенных газов. Он попадает в жидкие металлы вследствие разложения воды или углеводородов:
Me + Н2О -• МеО + 2[Н); С„Нт - пС + т[Н].
Растворение водорода в металлах ряда Мд — Fe (см. табл. 2.16) сопровождается поглощением теплоты. Снижение температуры вызывает уменьшение содержания газа в растворе. В этих металлах возможно образование газовой пористости, если расплав содержит большое количество водорода. Растворение водорода в титане является экзотермическим процессом„растворимость растет с понижением температуры и образование водородной пористости невозможно.
Взаимодействие с кислородом. Все жидкие металлы взаимодействуют с кислородом.
Легкоплавкие металлы — от олова до алюминия (см. табл. 2.16) — практически не растворяют кислород. Взаимодействие этих металлов с кислородом сводится к образованию оксидных плен на поверхности металла.
Остальные металлы способны растворять кислород в определенных количествах, после чего начинается образование оксидов.
Взаимодействие с азотом. Растворение азота в марганце, никеле и железе является эндотермическим процессом, вследствие чего эти металлы подвержены образованию газовой пористости, вызванной выделением азота из расплава.
В титане азот растворяется с выделением теплоты, что исключает образование газовой пористости.
Растворение азота в жидких сплавах металлов в общем случае пропорционально содержанию компонентов. Исключение составляют сплавы железа и никеля с добавками алюминия и титана. В этих сплавах образуются твердые нитриды титана и алюминия в виде включений.
Для металлов от олова до меди (см. табл. 2.16) азот практически является инертным газом.
Взаимодействие с водой. Большая часть металлов в жидком состоянии разлагает воду. Результаты взаимодействия расплава с водой зависят от характера его взаимодействия с водородом и кислородом.
Если расплав не растворяет ни водород, ни кислород, то в результате контакта с влагой расплав покроется пленой оксидов, а водород уйдет в атмосферу. Так ведут себя олово, цинк, свинец и все сплавы на их основе.
Если же расплав не растворяет кислород, но растворяет водород, происходит окисление поверхности расплава и насыщение его растворенным водородом.
Если расплав способен растворять и кислород, и водород, то именно это и будет происходить. Конечное равновесие в системе определяется парциальным давлением паров воды и концентрациями кислорода и водорода в расплаве.
Взаимодействие металлов с оксидом углерода. Взаимодействие металлов с оксидом углерода определяется возможностью прохождения реакций:
Me + СО - МеО + С; Me + СО -* [Me + О) + С; Me + СО - [Me + С + О].
Свинец, олово и медь с оксидом углерода практически не взаимодействуют, для этих металлов его можно рассматривать как нейтральный газ.
Для цинка, магния, алюминия СО является окислительным газом, взаимодействие с ним приводит к образованию нерастворимых оксидов на поверхности расплава.
Для остальных металлов, представленных в табл. 2.16, при понижении температуры равновесие между содержанием кислорода и углерода в расплаве сдвигается влево, т. е. в сторону образования СО. Следовательно, расплавы, содержащие растворенные углерод и кислород, при охлаждении и кристаллизации могут поражаться газовой пористостью, образованной оксидом углерода. Подобное, например, происходит в литейных углеродистых сталях в случае недостаточного раскисления.
Взаимодействие металлических расплавов с огнеупорными материалами. Огнеупорные материалы, которыми футеруют плавильные печи и из которых изготавливают плавильные тигли, должны быть при высоких температурах механически прочными и химически стойкими, чтобы не вступать во взаимодействие с металлическим расплавом, оксидами,, шлаками, флюсами.
Наиболее часто применяют шамот (60—75% SiOj, остальное — АЬОз), динас (более 95% SiOj, остальные — примеси), магнезит (80% МдО, остальное — СаО), хромомагнезит (45—50% МдО, 30—35% СгзОэ, остальное — SiOj), циркон (65% ZrOj, 35% SiOj), высокоглиноземистые огнеупоры (более 50% А12Оз, остальное — SiOj). Самым дешевым и доступным огнеупорным материалом является шамот.
Основной характеристикой этих материалов является огнеупор-н о с т ь — температура, °С, при которой материал способен выдержать напряжение сжатия 0,2 МПа (табл. 2.17). (Огнеупорность формовочных смесей оценивается температурой, при которой происходит деформация специальных образцов-конусов — см. гл. 3.)

Химическая стойкость огнеупоров определяется возможностью прохождения реакции между жидким металлом и огнеупорным оксидом
Me + RO- МеО + [R]Me; Me + RO - [Me + О + R],
где R — металл, входящий в состав оксида.
В результате этих реакций разрушается футеровка, расплав загрязняется оксидами и примесью R или кислородом и примесью R.
Кроме того, возможно взаимодействие оксидов огнеупора и оксидов металла, выражающееся во взаимном растворении. Оценить такое взаимодействие можно по виду диаграммы состояния МеО — RO. Если в системе МеО — RO имеются эвтектики с температурой плавления ниже температуры расплава, то при плавке на воздухе обязательно будет происходить активное разъедание футеровки.
Легкоплавкие металлы — олово, свинец, цинк — имеют столь низкие температуры плавления, что для их плавки пригодны любые из рассмотренных огнеупорных материалов. Однако при плавке свинца и его сплавов в шамоте перегревы до 750 ° С приводят к оплавлению футеровки вследствие того, что в системе РЬО — SiO имеется эвтектика с температурой плавления 715° С.
** Поскольку магний при температурах расплава около 850 ° С активно восстанавливает кремний из шамота, магниевые сплавы плавят в печах с магнезитовой футеровкой или в стальных тиглях.
При плавке алюминия также происходит восстановление кремния из кремнезема шамота. Поскольку шамот — наиболее дешевый материал, его используют для приготовления алюминиевых сплавов, если примесь кремния допустима в определенных пределах.
Медь и многие медные сплавы плавят в шамотной футеровке. Сплавы меди с цирконием, хромом и титаном получают в печах с магнезитовой футеровкой.
Для сплавов на основе никеля и железа шамот непригоден из-за недостаточной огнеупорности. Эти сплавы изготавливают в динасе, магнезите, хромомагнезите и цирконе.
Иногда металл плавят в графитовых тиглях, но чистый графит пригоден лишь для сплавов, не растворяющих углерод. Кроме того, его применение требует защитной атмосферы, поскольку при температурах, превышающих 600°С, графит на воздухе быстро сгорает. Как добавка в оксидные огнеупоры графит повышает стойкость материала. Широко известен графитошамот (40—50% графита), из которого делают плавильные тигли.
Расплавы, рабочие температуры которых не превышают 900 ° С, можно получать в стальных и чугунных тиглях. Главная опасность при этом — возможность насыщения расплава железом. Ее оценивают по диаграмме состояния «железо — расплавленный металл».
2.2. СПЛАВЫ 2.2.1. ФИЗИКО-ХИМИЧЕСКИЙ АНАЛИЗ
Сплав — это макроскопически однородная система, сформировавшаяся в результате совместного расплавления и затвердевания компонентов.
Компоненты сплавов — это химические элементы, образующие сплав. Они делятся на три группы:
1)основа — металлический элемент, доля которого в составе сплава наиболее велика;
2) легирующие добавки — элементы, вводимые в основу в определенных количествах в целях управления свойствами сплава;
3) примеси — элементы или химические соединения, попадающие в сплав из руды, основы сплава, легирующих добавок, топлива, атмосферы, огнеупоров.
Примеси подразделяют на вредные, снижающие эксплуатационные или технологические свойства сплава, и нейтральные, не оказывающие существенного влияния на свойства сплава.
Сплавы называются однородными (гомогенными), если они имеют однофазную структуру, и разнородными (гетерогенными), если структура их состоит из нескольких фаз (гомогенных частей, ограниченных поверхностью раздела).
Графическое изображение фазового состояния сплава как функции температуры и концентрации носит название диаграммы состояния. Диаграммы строят для условий равновесия или близких к ним. Истинное равновесие в практических условиях достигается крайне редко.
Академик Н. С. Курнаков установил, что между химическим составом сплавов и их свойствами существует определенная связь. Для разных типов диаграмм состояния им раскрыта закономерность изменения таких свойств, как плотность, твердость, удельное электрическое сопротивление и др.
Академик А. А. Бочвар на примере распределения усадочных дефектов в виде концентрированной раковины и пористости, а также изменения трещиностойкости показал, что существует зависимость между составом и технологическими свойствами.
Дальнейшим развитием этих идей явились работы профессора О. Н. Магницкого, в которых установлена связь кинетики кристаллизации сплавов различного состава с типом диаграммы состояния (рис. 2.4).
Кинетические диаграммы строились на основании термического анализа затвердевания реального слитка по показаниям одной термопары, расположенной в его центре. В частности, для сплавов с эвтектическим превращением фиксировалось время достижения центра слитка границами области затвердевания — ликвидуса (начала выпа-
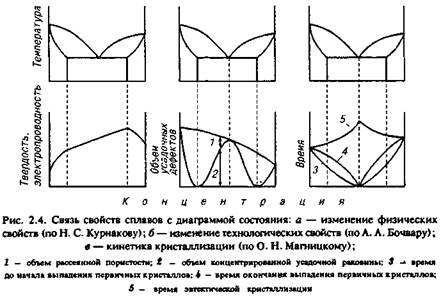
дения первичных кристаллов) и солидуса (конца выпадения первичных кристаллов) и затвердевания эвтектики.
Как показали исследования, достижение центра слитка последними двумя границами не совпадают по времени. Таким образом установлено, что перемещение каждой границы области затвердевания от поверхности слитка к его центру имеет свою закономерность.
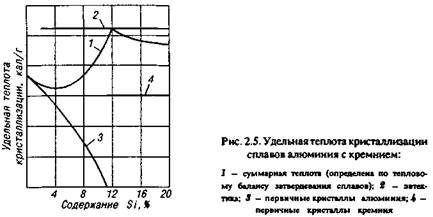
Кристаллизация эвтектики в сплавах «алюминий — кремний» сопровождается выделением значительно большего удельного количества теплоты по сравнению с первичными кристаллами (рис. 2.5).
Для литейного производства наибольший интерес представляют диаграммы состояния сплавов с эвтектическим превращением.
В отличие от твердых растворов, сплавы с эвтектическим превращением обладают высокими литейными свойствами. Хорошо известно, что такие эвтектические сплавы, как силумины и чугун, обладают высокой жидкотекучестью.
Рассмотрим процесс кристаллизации сплава концентрации с, характеризующегося неограниченной взаимной растворимостью компонентов Л и В в жидком и твердом состояниях (рис. 2.6, а). При температуре ti начинают выделяться первичные кристаллы с концентрацией с[. При температуре 1г концентрация первичных
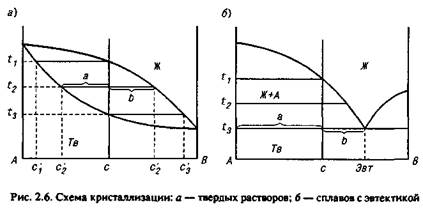
кристаллов соответствует с'г, жидкости — с£. Кристаллизация заканчивается при температуре f3- Последние капли жидкост и имеют концентрацию сз'.
Если процесс протекает медленно, в результате диффузии в твердых кристаллах химический состав выравнивается.
Если же охлаждение происходит быстро, наблюдается явление внутрикристаллитной ликвации. В центре кристалла концентрация близка к c'i, а на поверхности — к концентрации сз.
Соотношение долей жидкой и твердой фаз в процессе кристаллизации определяют по правилу отрезков. Так, при температуре h это соотношение будет равно а/Ь.
В процессе кристаллизации сплава с эвтектическим превращением концентрации с (рис. 2.6, б) при температурах, превышающих ft. оба компонента — А и В — полностью взаимно растворимы. При температуре t\ появляются первые зародыши кристаллов А в жидкой фазе. При температуре t3 заканчивается выделение кристаллов А и происходит кристаллизация оставшейся жидкости в виде эвтектики.
Соотношение долей эвтектики и кристаллов А в затвердевшем сплаве равно отношению а/Ь.
2.2.2. ЛИТЕЙНЫЕ СВОЙСТВА СПЛАВОВ
Жидкотекучесть. Это — способность металлов и сплавов течь по каналам формы и заполнять ее.
Заполнение литейных форм является сложным гидродинамическим и физико-химическим процессом. Главным фактором, определяющим уровень жидкотекучести, являются свойства сплава в жидком состоянии: теплофизические свойства, особенности кристаллизации, вязкость, окисляемость.
Влияние литейной формы связано главным образом с ее теплофи-зическими свойствами, со смачиваемостью жидким металлом, с условиями физико-химического взаимодействия «металл—форма».
На жидкотекучесть влияют также условия плавки и заливки, перегрев металла, насыщение металла посторонними включениями, условия подвода металла к форме.
Количественные значения жидкотекучести определяют по длине заполнения канала литейной формы с определенной площадью поперечного сечения. Наибольшее распространение получили технологические спиральные пробы.
При теоретическом анализе характеристики жидкотекучести основным является определение условий остановки движущегося потока. Высказано несколько точек зрения на механизм остановки потока: выделение 20% твердой фазы, образование на конце потока прочной твердой корочки, рост в канале литейной формы дендритов (древовидных кристаллов), препятствующих движению потока, накопление твердых кристаллов на конце потока.
Течение металла в литейной форме сопровождается кристаллизацией. Поэтому движущийся поток рассматривают как гетерогенную
жидкость. Из гидравлики известно, что движение таких жидкостей начинается только после того, как касательное напряжение становится больше определенного значения ст0, называемого предельным напряжением сдвига.
В гидравлике все тела условно делятся на несколько категорий в зависимости от отношения предельного напряжения сдвига ст0 к плотности/) (табл. 2.18). Основываясь на положениях гидравлики и учитывая фактор смыва и накопления твердой фазы в движущемся металле, можно представить механизм остановки потока следующим образом.
При поступлении металла в канал литейной формы на стенках канала образуется твердая корочка из-за высокой интенсивности охлаждения металла в начальные моменты. С течением времени, по мере

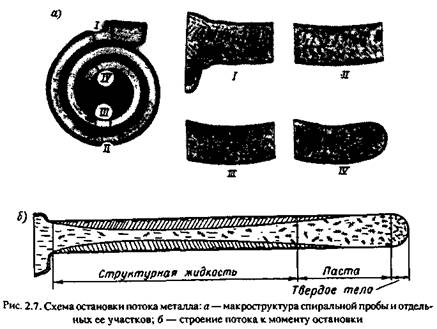
прогревания формы, интенсивность теплоотвода уменьшается. Но перенос теплоты к корочке за счет поступления новых порций металла остается постоянным, и она начинает оплавляться. Уменьшению размеров корочки способствует также смывание части кристаллов движущимся потоком. Накопление обломков кристаллов на конце потока приводит к постепенному нарастанию сил внутреннего трения. Условия течения металла заметно ухудшаются. Наконец в определенный момент количество накопившихся обломков становится настолько большим, а сопротивление внутреннему трению настолько значительным, что поток останавливается. Схема остановки потока металла показана на рис. 2.7.
Изменение жидкотекучести сплавов тесно связано с их диаграммами состояния. Академик А. А. Бочвар показал, что сплавы сохраняют основные свойства жидкого тела, в том числе способность к макроперемещениям, не во всем интервале температур между ликвидусом и солидусом, а только в той ее части, где кристаллы не образуют связанного каркаса, а движутся вместе с жидкостью. Профессор Ю. А. Не-хендзи назвал температуру, при которой поток перестает течь, температурой нулевой жидкотекучести.
С увеличением температурного интервала кристаллизации жидкотекучесть снижается. При этом большое значение имеют размеры и форма первичных кристаллов.
Если первичные кристаллы растут в виде сильно разветвленных дендритов, граница нулевой жидкотекучести находится вблизи границы ликвидус. Примером могут служить доэвтектические сплавы алюминия с кремнием и многие другие сплавы с широким интервалом кристаллизации и дендритной формой первичных кристаллов.
Если же первичные кристаллы имеют компактные формы и небольшие размеры, граница нулевой жидкотекучести тяготеет к линии солидус Несмотря на то что выделяется значительная часть твердой фазы, металл продолжает течь, поскольку выделившиеся первичные кристаллы не связаны между собой В качестве примера можно привести заэвтектические силумины и заэвтектические чугуны.
Заполняемое™. Она характеризует способность металлов и сплавов воспроизводить контур отливок в особо тонких сечениях, где в значительной степени проявляется действие капиллярных сил.
Заполнение тонких сечений отливок — это процесс взаимодействия металла и формы. Иногда этот процесс называют формовоспроизведе-нием или формозаполнением. Эти термины следует признать менее удачными, поскольку заполнение острых кромок и тонких сечений в большей степени зависит от свойств металла
Заполняемость обусловлена рядом факторов
1) поверхностным натяжением сплава и смачиваемостью формы;
2) вязкостью сплава, связанной с его теплофизическими свойствами;
3) температурным интервалом кристаллизации;
4) формой и размерами первичных кристаллов;
5) склонностью сплава к пленообразованию,
6) теплофизическими свойствами формы;
7) способом заливки металла (стационарный или центробежный);
8) конструктивными особенностями литниковой системы;
9) наличием газов в форме и условиями ее вентиляции.
На примере титана можно оценить влияние смачивания формы металлом на заполняемость. Угол смачивания титаном электрокорунда составляет 120°, а магнезита — 107°. Заполняемость корундовой формы для изготовления пластины толщиной 3 мм значительно хуже, чем магнезитовой (рис. 2 8).
Весьма эффективным средством, улучшающим заполнение тонких элементов отливок, является центробежная заливка.
На рис. 2.9 показаны зависимости центробежного и капиллярного давления для некоторых сплавов титана от поверхностного натяжения. В расчетах переменными факторами были скорость и радиус вращения, поверхностное натяжение.
Центробежное давление рц рассчитывали по формуле
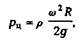
где р — плотность; а> — окружная скорость вращения; R — радиус вращения.

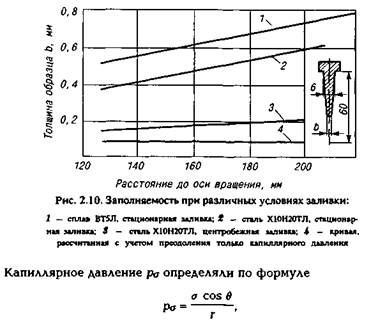
где а — поверхностное натяжение; в — угол смачивания; г — толщина канала.
При заполнении каналов с малой площадью поперечного сечения потоку приходится преодолеть значительное давление, обусловленное действием капиллярных сил. При незначительном удалении таких элементов от оси вращения необходима большая скорость вращения центробежного стола.
По мере продвижения потока металла по каналам литейной формы он охлаждается, меняется его вязкость, на конце потока могут накапливаться выпадающие кристаллы. Все это ухудшает заполняемость. Так, при стационарной заливке титаном и нержавеющей сталью треугольных призм (основание 6 мм, высота 60 мм, ширина 28 мм) по мере удаления от стояка заполняемость ухудшается (кривые 1 и 2 на рис. 2.10). При центробежной заливке этой же стали заполняемость хорошая (кривая 3), она близка к расчетным значениям (кривая 4), установленным только с учетом преодоления капиллярного давления.
Известно, что в ювелирном литье центробежная заливка является наиболее эффективным способом получения качественных отливок, отличающихся чрезвычайно тонкими сечениями элементов.
Характер затвердевания. Характер затвердевания металлов и сплавов определяет особенность перехода металла из жидкого состояния в твердое.
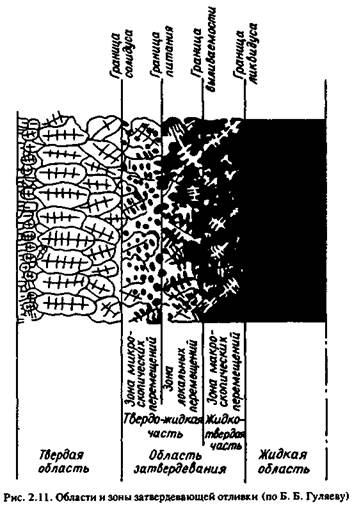
В процессе затвердевания реальной отливки в сплаве, кристаллизующемся в интервале температур, всегда развивается так называемая область затвердевания (рис. 2.11). Эта область ограничена изотермами ликвидус и солидус, которые в процессе охлаждения отливки последовательно перемещаются от ее поверхности к термическому центру.
Область затвердевания делится на две части — жидко-твердую и твердо-жидкую.
Жидко-твердая часть примыкает к изотерме ликвидус, твердо-жидкая — к изотерме солидус. Граница между ними носит несколько
названий: выливаемости, нулевой жидкотекучести, начала линейной усадки. Положение этой границы связано с формой и размерами первичных кристаллов. При сильной развитой дендритной форме она тяготеет к границе ликвидус, при компактной форме мелких кристаллов — к границе солидус.
Твердо-жидкая часть области затвердевания делится на две зоны границей питания. Между границей выливаемости и границей питания сросшиеся дендриты не препятствуют макроперемещениям жидкости. Между границами питания и солидус каркас дендритов образует изолированные области, внутри которых возможно только микроскопическое перемещение жидкости.
Параметры области затвердевания во многом определяют качество отливок, которое оценивается по заполнению литейной формы, развитию усадочных дефектов, по вероятности появления трещин, по формированию литой поверхности. Последнее особенно важно для художественного литья.
Математически строгий анализ процесса затвердевания отливки основывается на решении задачи, известной как задача Стефана, в которой рассматривается процесс промерзания влажного грунта. Решение этой задачи приводит к так называемому закону квадратного корня.
x = W7,
где х — расстояние от изотермы затвердевания до поверхности отливки (толщина твердой корки); г — время; k — коэффициент затвердевания.
Затвердевание металла является прежде всего тепловым процессом. Его развитие определяется в основном тем количеством теплоты, которое освобождается при переходе металла из жидкого состояния в твердое и условиями отвода теплоты из области затвердевания, что зависит от совокупности теплофизических свойств металла и форм.
Теплофизические свойства сплавов определяются теплотой затвердевания, теплоемкостью, теплопроводностью и плотностью. Причем для процесса затвердевания наиболее значима теплота затвердевания.
Критерием интенсивности теплоотвода служит коэффициент тепло-аккумулирующей способности формы.
Ь = Удср,
где А — теплопроводность; с — удельная теплоемкость; р — плотность.
Большое значение для развития процесса затвердевания имеет зазор, образующийся между отливкой и формой, так как он являетсяj звеном, передающим теплоту от отливки к форме.
Характер формирования литой поверхности. Под характером фор-; мирования литой поверхности металлов и сплавов подразумевают их |
способность воспроизводить профиль поверхности формы (шерохова-тось, механический пригар), склонность к образованию макронеровностей (спаи), склонность к химическому взаимодействию с формой (химический пригар).
Формирование литой поверхности определяется условиями взаимодействия расплава с материалом литейной формы. Эти условия зависят от целого комплекса факторов: от теплофизических свойств металла и формы, их химического состава, гидродинамики потока во время заполнения формы, от изменения физико-механических свойств металла и формы с изменением температуры.
Качество поверхности художественной оливки во многом определяет эстетическую ценность изделия. Важное значение имеет отражательная способность поверхности, обрабатываемость (шлифуемость и поли-руемость), взаимодействие с различными реагентами при патинировании.
Немаловажна и себестоимость изделия. Приходится искать технологические решения, позволяющие сочетать умеренные затраты на изготовление отливки с высоким качеством поверхности.
В машиностроении к качеству литой поверхности предъявляются другие требования, обеспечивающие высокие механические свойства, химическую стойкость, низкие гидравлические потери, обрабатываемость литой детали и др.
Шероховатость поверхности характеризуется средним арифметическим отклонением измеренного профиля от его средней линии Лв и высотой неровностей Rz, определяемой как среднее расстояние между пятью высшими точками и пятью низшими точками, находящимися в пределах базовой длины (ГОСТ 2789-73).
Шероховатость отливки непосредственно зависит от шероховатости поверхности формы. Чем крупнее зерна формовочного материала, тем больше шероховатость поверхности отливки.
Формирование профиля литой поверхности определяется двумя факторами — смачиваемостью формы металлом и условиями теплоотвода на границе «металл-форма» в начальный период затвердевания отливки. Смачиваемость оценивают по краевому углу смачивания, интенсивность теплоотвода — по температуропроводности (м2/с) формовочного материала а = А/(с^>).
Литейная форма является пористым телом. Ее пористость колеблется в пределах от 15 до 45%. Причем основная часть пор относится к капиллярным, т. е. таким, в которых форма поверхности жидкости зависит от поверхностных сил и мало искажена силой тяжести.
Проникновение жидкого металла в поры формы происходит при условии, если давление металла рм на границе «металл-форма» превышает капиллярное противодавление формы р»:
Рм > Pi-59
Давление металла
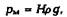
где Н — гидростатический напор металла (высота столба); д — ускорение силы тяжести; р — плотность жидкого металла. Капиллярное противодавление
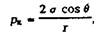
Где а — поверхностное натяжение; в — краевой угол смачивания формы металлом; г — радиус поры формы.
Таким образом, чтобы уменьшить проникновение металла в поры формы, следует идти по пути уменьшения г за счет применения мелкозернистого песка и увеличения a, cos в, зависящих от физических свойств металла и состава формовочной смеси. Так, краевой угол смачивания песчано-глинистой формы сталью зависит от содержания кислорода и серы в стали.
Если металл не смачивает материал формы, то он может проникать в ее поры только под действием металлостатического давления.
Глубину проникновения металла Л в поры формы можно определить по формуле
2 a cos в
h = H — ————. Р9*
Из приведенной формулы следует, что пока капиллярные силы превышают металлостатическое давление, механический пригар не j образуется.
На смачиваемость формовочных материалов расплавленным метал- ] лом влияет газовая атмосфера литейной формы. Например, при изго-| товлении стальных отливок в окислительной атмосфере ширина зоны) взаимодействия металла с формой увеличивается в 1,5—2 раза по| сравнению с изготовлением в воздушной атмосфере.
Механизм взаимодействия жидкой стали с формой, определяющий! качество поверхности отливок, можно представить следующим обра-1 зом. Если при заполнении формы жидкий металл проникает в поры| формовочной смеси, происходит образование механического пригара. Эта стадия заканчивается формированием твердой корочки металла на| поверхности отливки. Далее при взаимодействии металла с кислородом! окружающей газовой атмосферы образуются жидкие оксиды, прони-| кающие в формовочную смесь и вступающие с ней в химическое! взаимодействие.
В качестве примера химического взаимодействия можно рас-; смотреть реакции между стальной отливкой и песчано-глинистой; формой
4Fe + 2О2 2 4FeO; (1)
4Fe + 2SiO2 t 2(2FeO • SiO2); (2)
A12O3 • 2SiO2 + 4FeO t 2(2FeO • SiO2) + A12O3; (3)
A12O3 • 2SiO2 + 4Fe + 2O2 J 2(2FeO • SiO2) -I- A12O3. (4)
Основными составляющими песчано-глинистых смесей являются кварцевый песок, состоящий преимущественно из зерен кварца SiO2. и огнеупорная глина (каолинит) А12О3 • 2SiO2 • 2Н2О. При температуре 100° С и выше удаляется гигроскопическая влага. При температуре 450—600 ° С происходит распад каолинита на метакаолин и воду:
А12О3 • 2SiO2 • 2Н2О = А12О3 • 2SiO2 + 2Н2О.
Из анализа изменения изобарно-изотермического потенциала представленных выше четырех реакций вытекает, что преимущественное развитие получают реакции (1) и (4). Таким образом, с термодинамической точки зрения для уменьшения химического пригара на стальном литье желательно в форме создать восстановительную или же нейтральную атмосферу.
Объемная усадка. Объемная усадка металлов и сплавов характеризует изменение объема металла при понижении температуры в жидком состоянии, в процессе затвердевания и при охлаждении твердого металла.
Согласно схеме, предложенной А. А. Бочваром, полная объемная усадка распределяется между объемом концентрированной усадочной раковины и объемом усадочной пористости. Чем больше эффективная часть температурного интервала кристаллизации (разница температур начала усадки и солидуса), тем большая доля объемной усадки проявляется в виде усадочных пор. В сплавах, кристаллизующихся при постоянной температуре (чистые металлы, сплавы эвтектического состава), усадочная пористость практически не образуется (см. рис. 2.4, б].
Пример распределения полной объемной усадки для сплавов титана с медью приведен на рис. 2.12. Кривая / показывает изменение объема усадочной раковины, кривая 2 соответствует изменению полной объемной усадки сплавов. Заштрихованная область характеризует изменение объема усадочной пористости. На этом же рисунке приведены фотографии рентгенограмм темплетов (образцов, вырезанных из слитков) опытных сплавов.
Линейная усадка. Линейная усадка металлов и сплавов отражает изменение линейных размеров отливки после образования на ее поверхности жесткого кристаллического скелета и охлаждения отливки до комнатной температуры.
В отливках из чистых металлов температура начала линейной усадки соответствует температуре плавления. Линейная усадка в этом случае пропорциональна линейному коэффициенту термического расширения и разности между температурами плавления и комнатной:
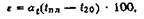
где е — коэффициент линейной усадки, %, at — средний линейный коэффициент расширения металла в интервале от tan Д° ^о; 'пл и (20 — соответственно температуры плавления и комнатная.
Участок диаграммы состояния между температурой начала линейной усадки и температурой солидус назван А. А. Бочваром эффективным интервалом кристаллизации.
Трещиностойкостэ- Это — способность металлов и сплавов к релаксации (ослаблению, уменьшению) напряжений, возникающих в отливке при затвердевании и охлаждении, в результате усадки, фазовых превращений или температурного перепада.
В практике литья обычно различают два вида трещин — горячие и холодные. Это деление весьма условно. Считается, что горячие трещины образуются в области, близкой к температуре солидус. По внешнему виду эти трещины отличаются окисленной поверхностью, в особенности — на стальных отливках. Холодные трещины, в отличие от горячих, имеют блестящую поверхность и образуются в области упругих деформаций при температуре, которая значительно ниже температуры окончания кристаллизации.
Свариваемость. От свариваемости сплавов зависит качество исправления дефектов отливок и надежность соединения литых деталей методом сварки.
Для художественных отливок это свойство имеет большое значение. Особенно важно обеспечить надежное соединение крупных элементов скульптур.
В литейной практике свариваемость обычно оценивают по склонности к образованию сварочных трещин и по разупрочнению околошовной зоны. Трещины в зоне сварного шва могут появиться при его остывании в результате возникновения больших термических напряжений. Свариваемость оценивают также, сопоставляя свойства шва и околошовной зоны со свойствами основного металла.
2.2.3. ЦВЕТОВЫЕ ХАРАКТЕРИСТИКИ СПЛАВОВ
Цвет художественной отливки является одной из важнейших эстетических характеристик.
Несмотря на то что выбор цветового решения художественного произведения — прерогатива художника, материаловед-литейщик может помочь воплотить это решение благодаря знанию закономерностей формирования структуры литейного сплава, химизма взаимодействия сплава с различными реактивами, используемыми для тонирования поверхности литья.
Одним из важнейших аспектов оценки цветовых характеристик изделия является количественное измерение цвета.
Проблема цветовосприятия, воздействия цвета на психику человека волновала умы многих деятелей науки и культуры. В течение нескольких веков делались попытки измерить цвет и дать ему количественную характеристику.
Еще в начале XVI11 века И. Ньютон перевел субъективное ощущение яркости и цвета на объективный язык меры, числа и физического закона.
И. В. Гете в книге «Учение о цвете» (1840 г.) описал физиологическое и психологическое воздействие цвета на человека. Он дал определение сочетанию цветов в цветовом круге. Сочетания противоположно расположенных цветов Гете назвал гармоничным, сочетания отдаленных соседних — характерным, сочетания соседних — негармоничным (рис. 2.13).
Развитие прикладного цветоведения связано с именем французского химика Эжена Шевреля (XIX век). Он оценивал цвет гобеленов, производимых в принадлежащих ему красильных цехах.
Американский ученый и художник Мензелл предложил в конце 90-х годов прошлого века классификацию цвета, основанную на распознавании шести психологических первичных цветов: белого, черного, желтого, красного, синего, зеленого.
Немецкий химик В. Освальд в начале XX века создал нормированную систематизацию цветов. Его цветовое тело включает 1536 цветов, каждый из которых определяется через строгое соотношение белого и черного и имеет цифровое и буквенное обозначение.
В 1966 г. в Японии разработано цветовое тело практической цветовой координатной системы. В ней каждый цвет обозначается номером цветовой фазы и названием тона цвета.
В России в настоящее время применяется принятая в 1931 г. Международная система МКО (Международного комитета по освещению). В основу оценки цвета по этой системе положены законы смешения. Цвет изменяется путем оптического смешения в различной пропорции трех основных цветов: красного, зеленого, синего. Любой цвет можно выразить через эти основные цвета. Измерение цвета основано на представлении, что цвет является функцией трех независимых величин и может быть интерпретирован как векторная величина. Полная характеристика цвета складывается из его цветности (длина волны), яркости (коэффициент отражения) и чистоты (насыщенности).
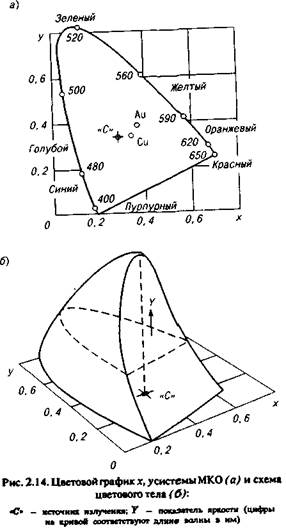
Для изучения цветовых характеристик материалов используют спектрографический метод, основанный на определении коэффициента отражения и координат цветности х и у.
На рис. 2.14 представлены схема и цветовой график системы МКО. Точкам кривой соответствуют цвета чистых спектральных излучений в видимой области спектра. Точки на графике характеризуют цветовые свойства чистых металлов — меди и золота.
С помощью этого метода во ВНИИювелирпроме было исследовано влияние легирования меди различными элементами на цветовые пара-
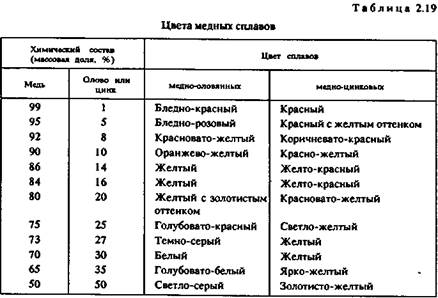
метры сплавов. Визуально такое влияние наглядно иллюстрируется при введении в медь олова и цинка. Цвет сплавов меняется от красного до 'золотисто-желтого (табл. 2.19).
Очевидно, что системы количественной оценки цвета художественных отливок могут быть использованы, например, для определения соответствия цвета изделия цвету эталона, как это было сделано во ВНИИювелирпроме при оценке качества имитаторов золота. Они могут также применяться для более качественного подбора цветовой гаммы литых изделий, в том числе для поиска цветовых нюансов, усиливающих эстетическое восприятие.
Проблема количественной оценки цвета до сих пор находится в стадии решения. Например, еще не раскрыта связь структуры сплава (кристаллической решетки, соотношения структурных фаз и др.) с цветом. Детальное рассмотрение этой проблемы выходит за рамки настоящего учебника. Более подробные данные можно найти в обширной литературе по цветоведению.
2.2.4. ВЫБОР ЛИТЕЙНЫХ СПЛАВОВ
Выбор сплавов для художественного литья — довольно сложная задача. Ее решение зависит от замысла художника, определяющего форму и цвет изделия, особенностей технологии литья и окончательной обработки отливки, себестоимости изделия. Поэтому можно дать лишь общие рекомендации.
Сплавы для литья ювелирных изделий и бижутерии. В ювелирной промышленности применяются сплавы, основой которых являются драгоценные металлы: золото, серебро и платина.
Золотые сплавы. В состав золотых сплавов в качестве легирующих добавок вводят серебро, медь, палладий, никель, платину, кадмий.
При введении серебра по мере увеличения его содержания цвет золота из насыщенного желтого переходит в желто-зеленый. Если содержание серебра превышает 30%, цвет становится желто-белым.
Медь повышает твердость золотого сплава. Сплав приобретает красноватые оттенки. При содержании меди, равном 14,6, сплав имеет ярко-красный цвет.
Палладий повышает температуру плавления. При 10%-ном содержании палладия цвет сплава становится белым.
Никель улучшает литейные свойства сплава. Сплав имеет бледно-желтый цвет. При большом содержании никеля сплав приобретает магнитные свойства.
Платина резко повышает температуру плавления, окрашивает сплав в белый цвет.
Цинк охрупчивает сплав, если его содержание превышает 0,3%.
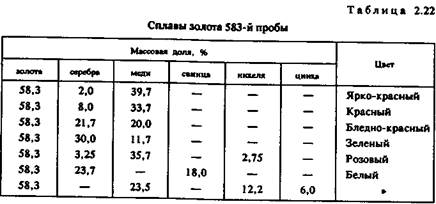
Сплавы золота подразделяют прежде всего по содержанию (%) золота, а затем уже по цвету и другим свойствам (табл. 2.20 — 2.23).
Номер пробы указывает, сколько массовых частей золота содержится в 1000 массовых частях сплава.
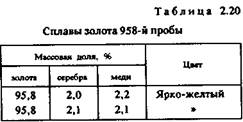
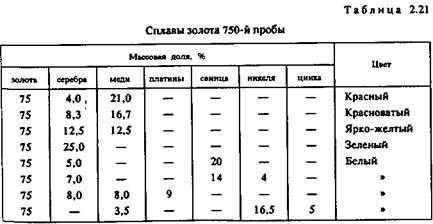
Несколько сложнее классифицировать золотые сплавы по цвету. Сплавы одной и той же пробы могут различаться по цвету или оттенку цвета. Наиболее широка цветовая гамма сплавов 583-й и 750-й проб. Они бывают белыми, серебристо-белыми, бледно- и ярко-желтыми, розовыми, оранжевыми, красноватыми и красными. Поэтому используемые иногда обиходные названия вроде «белое золото», «бледное золото», «желтое золото», «зеленое золото» и «красное золото» нельзя рассматривать как термины.
Маркировка золотых сплавов включает обозначение компонентов и их содержание. Буквенный шифр означает: Зл — золото; Ср — серебро; М — медь; Пд — палладий; Пл — платина; Н — никель; Кд — кадмий;
Ц — цинк. Цифры соответст-
вуют массовой доле (%) компонента в сплаве. Например, сплав марки ЗлВрПд 5-20 содержит 5% серебра, 20% палладия, остальное — золото.
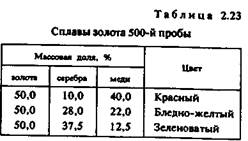
Серебряные сплавы. Сплавы серебра, используемые в ювелирной промышленности, в отличие от золотых, содержат только один легирующий элемент — медь. В соответствии с действующим стандартом серебряные сплавы должны иметь в своем составе 91,6%, 87,5%, 80% или 50% серебра. Маркируются серебряные сплавы аналогично золотым. Платиновые сплавы. В ювелирной промышленности применяются только два сплава на основе платины — с 5%-ным содержанием меди и с 5 % -ным содержанием иридия. Медь понижает температуру плавления. Иридий повышает эту температуру и одновременно износостойкость. Добавки не влияют на цвет сплава, и он остается характерным для платины.
Медные сплавы. Кроме сплавов на основе драгоценных металлов для ювелирных изделий широко применяются сплавы на основе меди (бронзы, латуни, нейзильбер, мельхиор).
Высокими художественными качествами обладают бронзы, которые ранее были известны под названием «Мангеймское золото», или «симилор» (7% олова, 9% цинка), бронза «орейде» (5% олова, 15% цинка), золотистая бронза «хризокальк» (7% олова, 3% цинка).
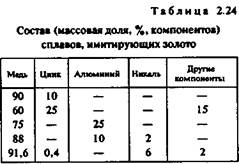
В конце XIX века в качестве заменителей драгоценных металлов стали широко применяться декоративные латуни, сплав хризит (36,8% цинка, 0,2% свинца), сплав Вигольди (31% цинка, 0,8% алюминия, 0,2% свинца) и в настоящее время при производстве украшений используются сплавы на основе меди, имитирующие золотые и серебряные сплавы (табл. 2.24).
Сплавы меди с цинком, алюминием, другими метал-
лами обладают широкой цветовой гаммой. Большой популярностью пользуется кремнистая латунь ЛК80-ЗЛ.
Поскольку большинство медных сплавов обладают невысокой коррозионной стойкостью, для защиты изделий применяют лаковые покрытия.
Добавки до 0,3% алюминия не приводят к образованию плен, но улучшают качество литой поверхности. Легирование медных сплавов алюминием несколько повышает их коррозионную стойкость.
Из всех бронз в ювелирной промышленности чаще всего используется бериллиевая бронза. Она отличается высокой твердостью и наиболее стойка коррозии.
Медно-никелевые сплавы с цинком, алюминием и другими металлами обладают высокими декоративными свойствами, имитируя серебро.
Мельхиор — двухкомпонентный медный сплав, содержащий 18—20% никеля. Он обладает красивым серебристым цветом, хорошо сопротивляется атмосферной коррозии. Широко применяется для изготовления столовых приборов и недорогих ювелирных изделий.
Нейзильбер — трехкомпонентный медный сплав — содержит 13,5—16,5% никеля и 18—22% цинка. Нейзильбер дешевле мельхиора. Он обладает достаточной коррозионной стойкостью и широко применяется в ювелирной промышленности.
В табл. 2.25 приведен химический состав других никелевых сплавов, имитирующих серебро.
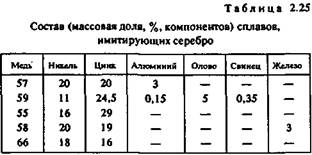
Кроме того, используется свинцовистый нейзильбер МНЦС 16-29-1,8. Сплав хорошо обрабатывается резанием, имеет высокую коррозионную стойкость, красивый серебристый цвет.
Для изготовления бижутерии применяют сравнительно дешевые легкоплавкие сплавы на основе цинка, олова, свинца и алюминия.
Для сплавов на основе первых трех металлов разработана специальная технология литья в резиновые пресс-формы (см. гл. 8).
Сплавы для литья колоколов. В старину существовало четыре сорта бронз: пушечная (13% олова), зеркальная (32% олова), монетная (7% олова) и колокольная (20% олова).
Пушки, зеркала и монеты теперь из бронзы не делают. А колокола по-прежнему льют из бронзы, причем ставший классическим состав колокольной бронзы сохранился до наших дней.
Колокольный металл окутан многими легендами. Люди верили в особую силу звучания колокола — очистительную, охраняющую, заклинающую. Звон колокола обращал мысли человека к силам природы, к небу, к высшему идеалу. Отсюда одна из основных функций колокольного звона — защита от бесов и злых духов. Звучанием колокола или колокольчиков пользовались жрецы, прорицатели, знахари.
Долгое время считалось, что рецепт колокольного сплава представляет собой тайну за семью печатями. Также полагали, что для красивого звучания сплав должен обязательно включать примесь серебра. Например, когда в 1911г. в городе Лодзи плавили колокольную бронзу в вагранке, жители города, собравшиеся поглядеть, как будут выпускать металл в ковш, бросали в расплав золотые и серебряные.вещи. А наблюдало за плавкой почти 900 человек.
Однако исследования, выполненные во второй половине XX века, развеяли красивые легенды. Примесь серебра в сплаве никак не влияет на звучание.
В музыкальном материаловедении основные требования, предъявляются к металлу, формулируются как наилучшее возбуждение, излучение всех частот, возникающих при ударе, и большая длительность звучания. Этим требованием отвечают металлы, обладающие высокой упругостью, низким затуханием звука, высокой плотностью и минимальной пористостью.
При оценке акустических качеств материалов используют константу, учитывающую плотность и внутреннее трение материала,
где q _ внутреннее трение; Е — модуль Юнга; р — плотность.
На звучании колокола плохо сказываются примеси, которые резко снижают акустические характеристики бронзы. Содержание примесей не должно превышать 2%, а в особо ответственных случаях — 1%. Примеси алюминия, висмута, мышьяка дают себя знать, даже если их содержание исчисляется в сотых долях процента.
Звучание колокольной бронзы определяется содержанием интерме-таллидной фазы CusiSng. Чем выше ее доля в сплаве, тем чище, звонче, мелодичнее звук. Однако эта фаза обладает исключительной хрупкостью. При 32 % -ном содержании олова колокол не выдержал бы и одного удара. Сплав с 22%-ным содержанием олова находится на границе области допустимой хрупкости.
Т
 2015-05-18
2015-05-18 7142
7142
