Выше уже указывалось, что внутримозговые сосуды отвечают суже
нием или расширением на целый ряд воздействий. Исходя из этого,
необходимо установить, настолько картина сосудисто-капиллярной сети
мозга после смерти животного является эквивалентной тому состоянию
ее, которое длительно существовало в мозгу перед смертью и было
вызвано экспериментальным путем.
Для решения последнего вопроса большое, если не решающее, значение имеет вид смерти животного и последующая гистологическая обработка материала.
Существует много разнообразных способов умерщвления животных после окончания опыта. Животное умерщвляют наркозом, электрическим током, перерезкой спинного мозга под продолговатым, удушением. используют введение в сердце формальдегида, декапитацию и другие способы.
Рассмотрим, хотя бы кратко, то состояние сосудисто-капиллярной сети мозга, которое имеет место при некоторых из перечисленных способах умерщвления животных.
На рис. 150 и 151 показана капиллярная сеть краевой извилины у нормальной взрослой кошки и кошки того же возраста, погибшей во время наркотизации (применялся обычный «кошачий» наркоз — 1 часть спирта, 2 части эфира, 3 части хлороформа). Как видно, смерть от наркоза вызывает отчетливое изменение состояния капиллярной сети мозга и выражается в значительном равномерном уменьшении просвета составляющих ее капилляров. Последовательная регистрация состояния сосудистой сети мягкой мозговой оболочки в случаях смерти животного от наркоза позволила нам проследить, насколько велики изменения диаметра сосудов, наступающие в этих условиях (Б. Н. Клосовский, Е. Н. Космарская, 1950). В этом можно убедиться при сравнении микрофотографии (рис. 152, а), сделанной с сосудов мягкой мозговой оболочки кошки, находившейся в слабом наркозе, с микрофотографией (рис. 152, е), снятой через 6 минут после смерти животного. Эти микрофотографии с достаточной очевидностью показывают, насколько далеко от действительности состояние сосудистой сети мягкой мозговой оболочки, наблюдающееся в случае смерти от наркоза.
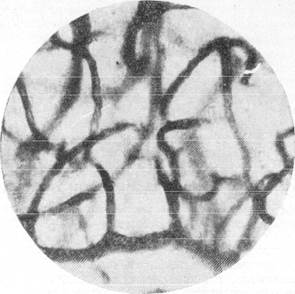
Рис. 150. Капиллярная сеть мозгового вещества нормальной взрослой кошки, убитой
декапитацией.
Импрегнация по методу Б. Н. Клосонского. Увеличение 400.
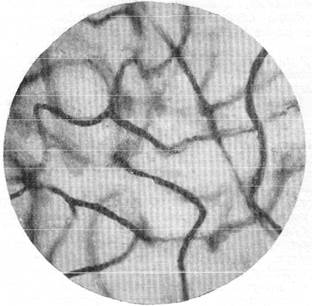
Рис. 151. Капиллярная сеть мозга кошки, погибшей от наркоза. Импрегнация по методу Б. Н. Клосовского. Увеличение 400.
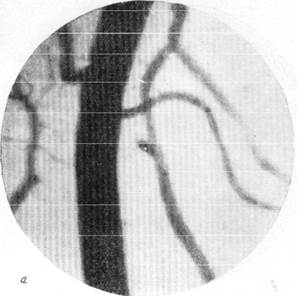
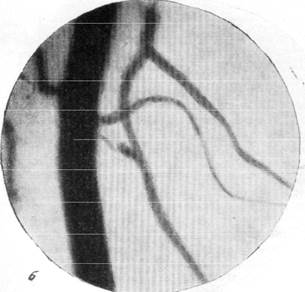
Рис. 152. Изменение сосудистой сети мягкой мозговой оболочки при смерти от наркоза.
а — артерии и вены мягкой мозговой оболочки во время сна кошки и состоянии
слабого наркоза; б — через 20 секунд после добавления наркоза.
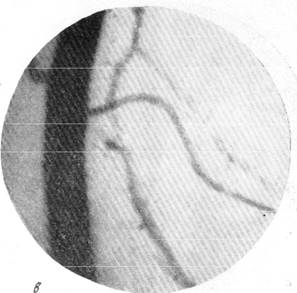
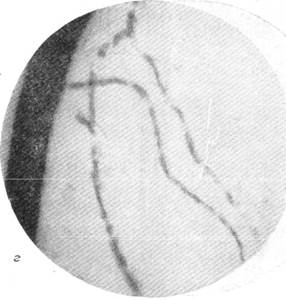
Рис. 152. Изменение сосудистой сети мягкой мозговой оболочки при смерти от наркоза.
в — через 25 секунд после остановки дыхания; г— артерии и вены через 1 минуту
10 секунд после остановки дыхания.
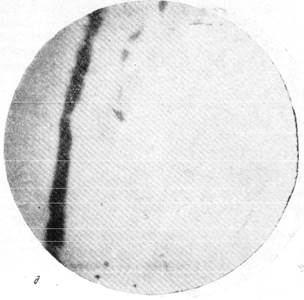
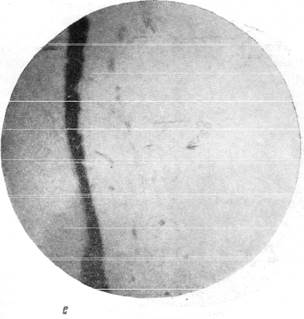
Рис. 152. Изменение сосудистой сети мягкой мозговой оболочки при смерти от наркоза. д — сосуды мягкой мозговой, оболочки через 3 минуты 40 секунд после остановки
дыхания; е — сосуды через 6 минут после остановки дыхания. Фото через «окно» в черепе с помощью капилляроскопа. Увеличение 60.
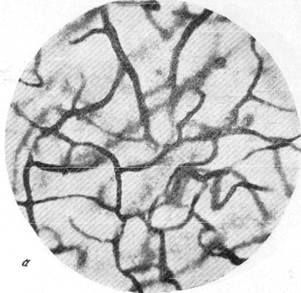
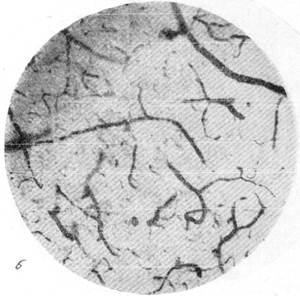
Рис. 153. Капиллярная сеть мозгового вещества после перерезки спинного мозга под
продолговатым.
а — импрегнация сосудисто-капиллярной сети мозга по методу Клосовского (увеличение 340); б — окраска по методу Зроса. Увеличение 150.
При сопоставлении состояния капиллярной сети мозга и состояния сосудистой сети в мягкой мозговой оболочке после смерти животного с состоянием той и другой до опыта можно видеть, что изменения сосудов значительно больше выражены в мягкой мозговой оболочке. Это обстоятельство находит свое объяснение в том, что расположение сосудов в мягкой мозговой оболочке и внутри мозга не одно и то же. В мягкой мозговой оболочке сосуды лежат свободно в петлях соединительной ткани, а большие сосуды — в субарахноидальном пространстве. Сосуды связаны с мозговым веществом только отходящими от них радиальными артериями и обладают возможностью изменить свой просвет в значительно больших пределах, чем сосуды и капилляры внутри мозга. Последние находятся в окружении нервной ткани и тесно связаны с ней, благодаря чему просвет их зависит от состояния всего мозгового вещества в целом.
На рис. 153, а, б представлена капиллярная сеть мозгового вещества собаки, убитой перерезкой «спинного мозга под, продолговатым. При рассмотрении микрофотографии, снятой с препарата мозга, обработанного по методу Эроса, можно видеть, что участки, содержащие заполненные кровью сосуды, чередуются с участками, в которых капилляры не содержат крови. Соответственно этому при обработке мозга той же собаки предложенным нами методом импрегнации сосудистой стенки серебром можно убедиться в крайней неравномерности просвета капилляров, формирующих сеть в мозговом веществе. Заполненным кровью капиллярам на рис. 153, б соответствуют более широкие капилляры на рис. 153, а, капиллярам, не содержащим крови, на рис. 152, б — суженные капилляры на рис. 153, а.
Описанное распределение крови и просвет мозговых капилляров отчетливо указывают на зависимость диаметра мозговых капилляров от посмертных перемещений крови в мозгу. Перемещение крови в мозговых сосудах неизбежно должно иметь место потому, что после перерезки спинного мозга вплоть до остановки деятельности сердца кровь по сонным и частично по позвоночным артериям поступает в мозг. Благодаря этому на состоянии кровенаполнения мозговых капилляров отражаются-все посмертные явления.
Другими словами, количество крови в мозговых капиллярах и просвет их будут различными в зависимости от силы и продолжительности судорог, агональных сокращений сердца и т. д.
Рассмотрим другой вид умерщвления животного—смерть от задушения.
При удушении животного, например, сдавленней дыхательного горла, оно погибает не мгновенно, а через несколько минут. Но до смерти животное производит ряд огромных мышечных напряжений, сердечная деятельность его резко повышается. Происходит перераспределение крови в организме за счет сужения сосудов в одних областях и расширения в других; значительное расширение сосудов наблюдается в мозгу, где-оно распространяется на все сосуды к капилляры. Благодаря этому сглаживаются всякие неравномерности в просвете сосудов и капилляров, существовавшие даже длительно до задушения.
Необходимо также отметить, что при задушении резко повышается внутричерепное давление и происходит расширение всей сосудисто-капиллярной сети. После остановки сердечной деятельности повышенное внутричерепное давление спадает, и кровь в значительном количестве уходит из мозга, подчиняясь простым гемодинамичеоиим законам. Ясно, что при таком перемещении крови нельзя ожидать со стороны сосудов
мозга какого-либо отражении функциональных состояний, существовавших у животного до смерти.
Как можно было видеть, характер смерти животного накладывает вполне определенный отпечаток на состояние капиллярной сети в мозгу. После предварительного рассмотрения влияния различных способов умерщвления животных на просвет капилляров мозгового вещества мы в наших опытах остановились на декапитации.
Мгновенная декапитация молодых животных, как правило, происходила без предварительной наркотизации. В тех же случаях, когда декапитация производилась взрослому, крупному по размерам животному, всегда вводилось небольшое количество наркоза для устранения влияния эмоциональных факторов в момент смерти животного.
Проделанные опыты позволили установить, что этот вид умерщвления у нормального животного всегда дает одну и ту же картину сосудисто-капиллярной сети мозга. Кроме того; декапитация всегда одним и тем же образом отражает состояние капиллярной сети мозгового вещества, вызванное перед смертью животного экспериментальным путем (отек, анемию, асфиксию и т. д.).
Таким образом, мгновенная декапитация устраняет в наибольшей степени возможность перемещения крови в сосудах вследствие отсутствия при данном роде смерти атонального периода. Вместе с тем она ставит мозг всех экспериментальных животных в одни и те же условия асфиксии, продолжающейся в течение 5—6 минут с момента декапитации до момента гибели нервных клеток. В пределах одного и того же мозга асфиксия в ранной мере распространяется на все отделы мозгового вещества и имеет своим следствием незначительное расширение всей сосудисто-калпиллярной сети мозга в целом. Расширение сосудистого русла в свою очередь приводит к удержанию значительной части крови, находившейся б момент смерти в сосудах мозга, благодаря чему при дакапитации не наблюдается истечения крови из мозговых отделов перерезанных сосудов.
Исследуя в нашей лаборатории изменения сосудисто-капиллярной сети спинного мозга в случаях декапитации различных животных, М. Е. Афанасьев отметил, что состояние сети в этом отделе центральной нервной системы значительно отличается от состояния ее в головном мозгу.
Капиллярная сеть головного мозга нормального животного после мгновенной декапитации характеризуется равномерностью просвета составляющих ее капилляров. В опийном мозгу, напротив, капилляры отличаются крайним разнообразием диаметров. Капиллярная сеть здесь включает в свой состав как расширенные,так и заметно суженные по сравнению с нормой капилляры.
Следует отметить также существование на всех уровнях спинного мозга кровоизлияний типа per diapedesis, никогда не наблюдающихся при декапитации в головном мозгу. Неравномерность диаметра капилляров, так же как и наличие кровоизлияний, объясняется тем, что в сосудистой сети продолговатого мозга происходит значительное перераспределение крови вследствие постепенного замедления сердечной деятельности и атональных сокращений мышц туловища и конечностей.
Особенно важно, чтобы декапитация была мгновенной и производилась острым инструментам. Известно, что перерезка спинного моега острым скальпелем вызывает повышение сухожильных рефлексов, перерезка же тупым инструментом - угасание их (Лапимоний и др.).
Отсюда ясно, что мгновенная декапитация не производит резкого
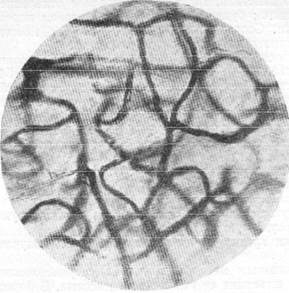
Рис. 154. Капиллярная сеть мозгового вещества
нормальной собаки.
Импрегнация по методу Б. Н. Клосовсвого. Увеличение 340.
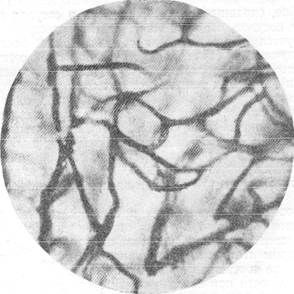
Рис. 155. Капиллярная сеть мозгового вещества после нескольких попыток декапитировать животное (собака).
Импрегнация по методу Б. Н. Клосовского. Увеличение 340.
травмирующего действия, тогда как неудачное отделение головы после нескольких попыток будет иметь своим следствием перемещение крови в сосудах мозга. Соответственно с этим сосуды мозгового вещества будут обнаруживать неравномерность просвета.
Справедливость оказанного подтверждается при сравнении микрофотографий (рис. 154 и 155) между собой. На рис. 154 представлена капиллярная сеть собаки, убитой мгновенной дакапитацией, а на рис. 155 показана капиллярная сеть в той же извилине серого вещества у собаки, убитой после нескольких попыток. При сопоставлении характера капиллярной сети на этих рисунках видно, что в случае мгновенной декапита-ции капиллярная сеть Сформирована из капилляров одинакового диаметра, в то время как при условии повторных попыток отделения головы капилляры характеризуются неравномерностью диаметров, значительное количество их резко сужено.
Вторым моментам, необходимым для решения доставленных вопросов, как уже указывалось, является выбор соответствующих методик, выявляющих сосудистую сеть мозга.
Остановимся кратко на имеющихся способах получения сосудистой сети мозга.
Распространенным методом изучения сосудисто-капиллярной сети мозга является инъекция ее различными массами. В качестве инъициру-емых веществ могут быть использованы самые разнообразные массы и краски. Введение в сосудистое русло так называемых затвердевающих масс при последующей коррозии мозгового вещества позволяет получить слепки сосудов. В случае контрастности вводимых масс возможно изучение сосудистой сети мозга при помощи рентгенограмм.
Производится инъекция сосудисто-капиллярной сети мозга растворами различного рода красящих веществ. Некоторые из них, например, chlorosol sky blue, окрашивают содержащуюся в сосудах плазму крови, а также стенку сосудов, что позволяет выявить ее структурные особенности. Используется также инъекция сосудов мозга раствором туши. Во всех этих случаях изучение сосудисто-капиллярной сети мозга может быть предпринято как на больших кусках мозга (просветленного особыми способами), так и на гистологических срезах.
Обладая рядом преимуществ, метод инъекций, однако, имеет и существенные недостатки. Главнейшие из них заключаются в том, что для инъекции всегда требуется свежий, не фиксированный мозг, располагающийся в закрытом черепе, или по крайней мере в твердой мозговой оболочке. Совершенная инъекция, предпринимаемая с целью выявить всю сосудисто-капиллярную сеть мозга, требует тщательного выбора инъицируемой жидкости и силы давления при введении ее в сосудистое русло.
Необходимость соблюдения этих предосторожностей делает метод инъекции совершенным лишь в руках ограниченного круга опытных в этой области исследователей. Использование этого метода недостаточно опытными экспериментаторами часто приводит к представлению сосудистой сети мозга, не соответствующему действительности.
Большие трудности при использовании этого метода с особой отчетливостью выступают при попытках представить состояние сосудистой сети мозга до смерти по тем картинам, гистологическое или рентгенографическое изображение которых подлежит рассмотрению после инъекции.
В самом деле, слишком большая сила.инъекции может иметь своим следствием искусственное расширение сосудов и капилляров или даже
ЗС6
раскрытие временно закрытых капилляров. Безусловно, это не может не исказить истинное состояние сосудисто-капиллярной сети мозга, существовавшее к моменту смерти. Напротив, при уменьшении силы инъекции будет наблюдаться частичное заполнение сосудистой сети мозга, в результате чего участии мозгового вещества, содержавшие суженные сосуды, могут оказаться совсем неинъицированными. Мы, со своей стороны, можем указать, что просвет капилляров на препаратах мозга, инъицированных какой-либо массой или краской, всегда меньше, чем просвет их на препаратах, обработанных методом импрегнации сосудистой стенки.
Усилие, прилагаемое экспериментатором при инъекции, может значительно сгладить или далее полностью затушевать те различия в диаметре капилляров в различных участках мозга, которые могли характеризовать их в силу того или иного физиологического состояния перед смертью. И с этой точки зрения требуют проверки результаты тех работ, авторы которых пытались установить отличие физиологических состояний, вызванных во время опыта в различных отдачах мозга, с помощью метода инъекции (см., например, работы Тзанга, 1936 и 1940 гг.).
Указанный метод непригоден также для выявления полностью закрытых и атрофирующихся капилляров. Ограничено применение этого метода и при экспериментальной работес животной молодью. Сосудисто-капиллярная сеть мовга в своем развитии проходит длительный период диференцировки, прежде чем достигает того оформления, которое мы наблюдаем в мозгу взрослого человека и животных. У животных до 2—2'/2 месяцев постнатальной жизни в отдельных участках мозга можно еще обнаружить строящиеся капилляры. Эти строящиеся капилляры, так же как и не полностью канализированные капилляры, врастающие в кору на начальных этапах развития и формирования сосудистой сети мозга, не могут быть выявлены с помощью метода инъекции.
Ограниченными возможностями использования метода инъекции, а также большими техническими трудностями и вытекающими отсюда ошибками толкования нужно объяснить длительный литературный спор относительно строения сосудистой сети головного мозгa. Только погрешности этого метода могли так длительно удерживать представления об артериях мозга как конечных в анатомическом смысле. Лишь усовершенствование метода инъекции дало возможность получить сосудисто-капиллярную сеть мозга такой, какая она есть в действительности, т. е. в виде непрерывной сети, расположенной в трех плоскостях.
Таким образом, подводя итога рассмотрению пригодности метода инъекции для получения сосудистой сети мозга, можно сказать, что при соблюдении необходимых условий этот метод позволяет производить изучение анатомии сосудов мозга. Это значит, что при инъекции можно проследить характер сосудистой сети в том или другом участке мозга, соотношение между артериями и венами, способ ветвления тех и других (да и то с известным учетом той же силы инъекции), наличие или отсутствие анастомозов между сосудами.
Что же касается возможности отражения физиологических особенностей состояния сосудистой сети мозга животного, вызванных перед его смертью экспериментальным путем, то нужно указать на ограниченность применения метода инъекции для этой цели в силу почти полной не-адэкватности картин, получаемых после нее.
Следовательно, и в наше время гистологические методы окраски или импрегнации сосудистой сети имеют решающее значение при получении
картины сосудистой сети, соответствующей (эквивалентной) действительному состоянию ее к моменту смерти животного.
Как уже указывалось, инъекция сосудов мозга различными веществами допускает лишь ограниченное суждение даже в таком чисто анатомическом вопросе, каким является вопрос об артериальном или венозном характере сосудов мозга, в зависимости от того, каким образом отходят боковые ветви от этих сосудов.
Известно, что классификация сосудов мозга на артерии и вены, предложенная Пфайфером (исследователем, чрезвычайно опытным в деле инъекции и изучения сосудов мозга), на основании особенностей ветвления их впоследствии была отвергнута. Необходимо было прибегнуть к гистологическому методу выявления стенки мозговых сосудов (М. Э. Мандельштамм, 1936; Кэмпбелл, 1938). чтобы показать ошибочность представлений Пфайфера и убедиться, что артерии Пфайфера по существу являются венами, а вены — артериями.
Немало попыток было сделано для получения сосудистой сети мозга с помощью гистологической обработки срезов фиксированного мозга.
Не останавливаясь на методах выявления различных элементов мозгового вещества и только попутно выявляющих сосуды, мы переходим к краткому перечислению методов, целью которых является специальное обнаружение тем или другим способом исключительно сосудов мозга.
Прежде всего укажем на метод прижизненной окраски, предложенный Кэмпбеллом (1938). Животному под наркозом в вену нижней конечности инъицируется 14% chiorosol sky blue, растворенная в дестиллиро-ванной воде. Введение краски продолжается вплоть до смерти животного, которая обычно наступает через 10—15 минут после начала инъекции. В течение всего этого времени кровь вместе с краской проходит в мозг и окрашивает стенки сосудов, а также содержащуюся в сосудах плазму, которую частично замещает.
Достоинство этого метода заключается в том, что он дает возможность составить представление о количестве капилляров в мозгу, открытых к моменту смерти животного. Кроме того, он дает возможность сравнительной оценки диаметра капилляров в различных участках мозга, так как в каждый данный момент и момент смерти все капилляры мозга находятся в одних и тех же условиях асфиксии определенной степени. Ограниченность использования этого метода заключается в том, что его можно применять лишь на лабораторных животных.
Наибольшее количество методов выявления мозговых сосудов основано на окраске бензидином красных кровяных шариков, оставшихся в сосудах после смерти животного или человека. Все эти методы с многочисленными модификациями [Пиквортс, 1934—1937; Сьестранд (Sjo-strand), 1934; Кэмпбелл, Александер и Путнем, 1938; Дохерти, Шу и Александер (Doherty, Shu, Alexander), 1938, и т. д.] дают возможность получения сосудистых образцов мозга на нормальном и патологическом материале человека и животных.
Однако, значительно расширяя по сравнению с методом инъекции представления о строении и функциональном состоянии сосудистой сети мозга, эти методы имеют и свои недостатки. Главнейший из них заключается в том, что эти методы все же в основном являются количественными, т. е. дают возможность судить о количестве заполненных к моменту смерти сосудов и капилляров.
Окраска эритроцитов без окраски плазмы сосуда искажает представление об истинной величине просвета его. Это с особой отчетливо-
стью выступает в тех случаях, когда сосуды мозга содержат мало крови и при окраске эритроцитов последние располагаются в виде редких цепочек. Такого рода «пунктирное» расположение эритроцитов безусловно создает неправильное представление о сужении сосуда, хотя, наряду с малым количеством эритроцитов, в сосуде и капилляре может содержаться достаточное количество плазмы и действительный просвет сосуда будет шире полученного на препарате. Это положение находит свое подтверждение на препаратах, приготовленных из патологического материала, когда окрашивается и патологически измененная стенка сосуда. На этих препаратах отчетливо видно, что подлинный просвет сосуда намного превышает просвет его, если о нем судить лишь по количеству содержащихся в нем эритроцитов.
В заключение упомянем о методе, предложенном Экштейном (Eckstein, 1935), заключающемся в предварительной инъекции сосудистой системы мозга кровью с последующей окраской ее каким-либо из методов выявления остаточной крови.
В ряде работ, предпринятых нами и сотрудниками нашей лаборатории, по изучению сосудистой сети при различных физиологических и патологических состояниях мозга, вызванных у животного эксперимен тальным путем, мы подошли к решению интересовавших нас вопросов применением целого ряда методов выявления сосудов мозгового вещества.
Метод получения коррозионных препаратов сосудистой сети мозга, налитой полиметилметакрилатом, использованный в уже упоминавшейся работе Е. В. Капустиной, оказался эффективным лишь при изучении анатомического распределения сосудов в мягкой мозговой оболочке.
Для изучения сосудистой сети мозгового вещества мы использовали метод прижизненной инъекции по Кэмпбеллу, метод окраски остаточной крови по Эросу, предложенную нами методику серебряной импрегнации сосудистой стенки и метод Масона.
Метод Эроса (1941), употреблявшийся нами для выявления крови, оставшейся в сосудисто-капиллярной сети мозга после смерти животного, сводится к окраске эритроцитов кислым фуксином. Обладая недостатками всех методов подобного рода, этот метод имеет в то же время и ряд преимуществ, заключающихся в следующем:
1) он пригоден для работы на материале различной длительности
формалиновой фиксации — от самой свежей до фиксации, продолжав
шейся годы;
2) допускает работу на замороженных, целлоидиновых и парафи
новых срезах;
3) основное преимущество этого метода (как было пока
зано в наших уже опубликованных работах) заключается в том, что
окраска кислым фуксином до известной степени отражает функциональ
ное состояние мозгового вещества, вызванное у животного перед его
смертью.
Особенно отчетливо это выявляется в тех случаях, когда в мозгу имеются те или другие изменения, связанные с нарушением водного обмена.
При окраске кислым фуксином мозга нормального животного, убитого декапитацией, выявляются все сосуды, содержащие красные кровяные шарики. Сосуды располагаются на совершенно бесцветном фоне, причем ни один элемент нервной ткани фуксином не окрашивается. Другая картина наблюдается в случаях окраски мозга животного, убитого декапитацией после предварительно экспериментально вызванного отека мозга.
В этом случае сродство к кислому фуксину обнаруживают не только эритроциты, но и основная парапластическая субстанция, красящаяся тем интенсивнее, чем более изменено ее химическое состояние в сторону закисления. В основной субстанции обнаруживается окрашенная зернистость, которая возможно и обусловливает окрашивание парапластиче-ского вещества
При сильно выраженных отечных состояниях мозговой ткани, подтверждаемых и другими гистологическими методами, окрашиваются нервные клетки, нервные волокна в белом веществе, а также стенка сосуда и отчасти плазма, содержащаяся в нем. Таким образом, применение этого метода позволяет судить не только о количестве заполненных кровью сосудов, но в определенных случаях и о физиологическом состоянии мозгового вещества перед смертью животного. Этот метод оказался также чрезвычайно удобным для выявления кровоизлияний различной давности.
Для устранения недостатков и дополнения описанных методов и обычных методов гистологической обработки, употреблявшихся нами (окраска гематоксилин-эозином, методы Ниссля, Кахаля, Гортега, Мас-сона и др.), нами была разработана специальная методика.
Предложенный нами метод выявления сосудисто-капиллярной сети мозга в кратких чертах заключается в следующем.
При температуре, равной 14—17°. мозг вынимается из черепа де-капитированного животного через 2 часа после смерти. При более высокой комнатной температуре вскрытие делается через 1/2—1 час. Во время вскрытия принимаются все меры предосторожности для избежания сдав-ления мозга. В банке с формалином мозг кладется на вату. Соотношения между объемом формалина и объемом мозга приблизительно равняются 1: 5. На следующий день формалин обязательно меняется. После пятидневной фиксации мозг разрезается на куски в желаемой плоскости, обычно не толще 1 см. Формалин при этом снова меняется. Разведение формалина должно быть различным в зависимости от вида и возраста животного (от 5 до 10%). Фиксация производится при температуре 17—20° в банках с доступом воздуха.
Для импрегнации сосудисто-капиллярной сети берутся куски мозга толщиной в 1 см через одно или оба полушария головного мозга, через зесь мозжечок, варолиев мост или весь продолговатый мозг. В течение двух суток взятые куски промываются в проточной воде, а затем еще сутки в дестиллированной воде, которая меняется через 3—5 часов.
В дальнейшем материал переносится в раствор 2% двухромовокис-
лого каЛИЯ (на 100 см3 этого раствора прибавляется1 см2 40% фор-
малина). В указанных растворах кусочек мозга остается в продолжение 2—3 дней. Раствор каждый день меняется. Затем куски мозга помещаются в 2% раствор двухромовокислого калия, в котором они находятся также 2—3 дня.
Как и предыдущий, этот раствор ежедневно меняется. При проведении материала через тот и другой растворы необходимо держать банки в полной темноте и несколько приоткрывать их для доступа воздуха. После проведения в двухромовокислом калии кусочки мозга в течение 1 часа промываются в дестиллированной воде и помещаются в 3—4% раствор азотнокислого серебра. В последнем они лежат на рассеянном свету в полузакрытых банках.
Дальше следует обычная заливка в целлоидин (в темноте), производимая очень медленно, во избежание разрывов сосудов и капилляров в мозгу. Залитые в целлоидин куски мозга режутся толщиной по
150—300 м, тщательно просветляются и накрываются покровным стеклом. В результате на белом или слегка желтоватом фоне оказывается импре-гнированной только сосудисто-капиллярная сеть мозга. Препараты хранятся в полной темноте.
При дефектах проводки фон может стать слабо или густо коричневым, поверхностные слои коры могут быть забиты кристаллами серебра, импрегнация сосудистой сети будет только местами. При уменьшении процента серебра и несоблюдении указанных условий проводки, наряду с сосудами, возможна импрегнация нервных клеток с их отростками, астроцитов, олигодендроглии, а иногда и гортеговской глии.
Нужно отметить, что предлагаемая нами методика пригодна лишь для выявления сосудисто-капиллярной сети головного и спинного мозга. Ввиду иного химического состава капилляров в других органах и тканях они не импрегнируются.
Как можно было видеть, в основу данной методики были положены принципы уже существующих импрегнационных методик. Известно, что на так называемых неудачных препаратах, обработанных серебром для импрегнации или только нервных клеток, или только какой-либо формы глии, местами можно видеть импрегнированными только капилляры.
Первой нашей задачей при выработке импрегнационной методики, выявляющей только капилляры мозга, было установление тех условий, которые необходимо было внести в существующие уже методики для того, чтобы импрегнировать только капилляры.
Второй задачей было добиться импрегнации капилляров не на отдельных срезах, а импрегнации целых кусков мозга для получения непрерывных серий срезов. Наконец, нужно было выработать метод, пригодный для работы с мозгом после обычной формалиновой фиксации. Это было необходимо для того, чтобы из одного и того же мозга можно было получить не только препараты с сосудисто-капиллярной сетью, но и препараты, обработанные другими методиками, выявляющими нервные клетки, волокна и глиозную ткань.
После длительного ряда исследований удалось выработать импре-тнационную методику с таким раствором серебря и такой предварительной обработкой мозговой ткани, чтобы можно было импрегнировать только одну капиллярную сеть мозга с артериями и венами.
Достоинства этого метода состоят в том, что для использования его не требуется специальной фиксации материала и возможна обработка мозга после обычной формалиновой фиксации. Но лучшие препараты получаются после фиксации в 5—6% формалине. Помимо того, для обработки предложенным нами методом могут быть использованы не только куски мозга новорожденных и взрослых животных и человека, но и мозг эмбрионов и даже целые эмбрионы.
Огромное преимущество метода импрегнации заключается в том, что серебрение сосудистой стенки дает возможность получить всю сосудистую сеть в целом, независимо от наполнения ее кровью и от степени расширения или сужения составляющих ее капилляров. Как свидетельствуют представленные в этой работе микрофотографии (рис. 86, 87, 88, 92, 94, 153 я т. д.), метод импрегнации выявляет расширенные, суженные, частично или полностью закрытые и даже строящиеся капилляры. Непрерывные серии срезов, из которых каждый имеет толщину 150—300 м, приготовленные из импрегнированных участков мозга, позволяют получить весьма точные данные относительно тонкого строения капиллярной сети мозга и таким образом составить представление о функционировании ее перед смертью животного. Наконец, нужно отметить широкие
возможности фотографической документации с импрегнационных препаратов. В то же время эти возможности весьма ограничены при употреблении методов Эроса и Кэмпбелла, допускающих получение отчетливых фотографий лишь при плотном заполнении сосудов кровью и при отсутствии закрашивания парапластического вещества.
Последним обстоятельством и объясняется то, что основная масса микрофотографий, приведенных в данной работе, снята именно с импре-гнированных препаратов, приготовленных по методу Клосовского.
Однако, как и каждый метод, метод импрегнации имеет свои недостатки. Важнейший из них состоит в невозможности изучать тонкую структуру сосудистой стенки, импрегнированной серебром. К недостаткам его может быть отнесена также тщательность проводки материала и длительность ее для мозга взрослого животного и человека.
Все сказанное выше и побудило нас вести постоянную корреляцию полученных нашим методом данных другими методами гистологической обработки экспериментального материала.
Таким образом, разработав описанный выше метод импрегнации, позволявший выявлять сосудисто-капиллярную сеть мозга полностью и дополнив его другими методами гистологической обработки, мы получили возможность изучать физиологическое состояние мозга в более широких пределах, чем это могли сделать другие исследователи. Результаты исследований, ведущихся в этом направлении, будут изложены в специальном труде.
Глава XI
СООТНОШЕНИЯ МЕЖДУ НЕРВНЫМИ КЛЕТКАМИ И КАПИЛЛЯРАМИ
Интимное взаимоотношение нервных клеток и капилляров представ-ляет собой наиболее важный и интересный вопрос проблемы циркуляции крови в мозгу. До настоящего времени исчерпывающего ответа на этот вопрос не существовало, вследствие отсутствия методов, допускающих одновременное изучение клеточного я сосудистого строения головного мозга. Для того чтобы понять характер взаимодействия нервной клетки с окружающими ее капиллярами, необходимо получить ва одном и том же препарате оба компонента нервной ткани.
Существующие методы гистологической обработки позволяют выявлять и изучать в деталях только нервную клетку или капилляр. Попытки дополнить один метод другим пока не дали вполне удовлетворительных результатов. В самом деле, изучение клеточного строения нервной ткани требует гистологических срезов, не превышающих 30 м, но на срезах указанной толщины утрачивается трехмерное расположение сосудистой сети. При выявлении сосудистой сети моага с наибольшей полнотой на препаратах толщиной в 150—300 м дополнительная окраска с целью получения нервных клеток делает невозможным дальнейшее исследование вследствие совершенной непрозрачности (препарата. Пригодными для изучения взаимоотношений клеток и капилляров являются препараты с полностью представленной сосудисто-капиллярной сетью, на которых иногда оказываются импрегнированными также отдельные нервные клетки или группы их.
Среди серий препаратов, обработанных предложенным нами методом импрегнации сосудистой стенки серебром, можно найти такие, в отдельных участках которых оказываются выявленными одиночные нервные клетки, а иногда даже группы клеток. Воспользовавшись такими препаратами, мы прежде всего обратили внимание на взаимодействие капилляров я больших пирамидных нелегок коры.
На рис. 156, а, б, в, г видна одна из таких клеток, располагающаяся в капиллярной петле. Рассмотрение этих микрофотографий позволяет отметить, что при фотографирований до известной степени искажается диаметр капилляров, лежащих в различных плоскостях. Кажется, что капилляры, находящиеся в фокусе, имеют больший диаметр по сравнен нию с капиллярами, расположенными вне фокуса. Кроме того, при фокус -ном фотографировании почти полиостью исчезает представление о пространственном расположении сосудисто-капиллярной сети в мозгу. Указанные недостатки фотографической документации побудили нас допол-
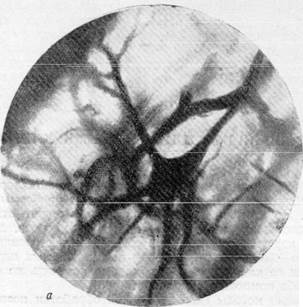
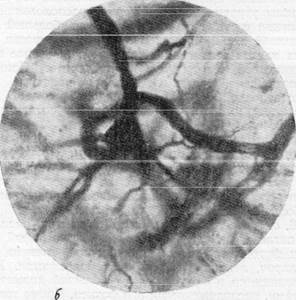
Рис. 156, а, 6. Микрофотографии, иллюстрирующие расположение пирамидных клеток
коры полушарий головного мозга в капиллярной петле. Импрегнация по методу Б. Н. Клосовского. Увеличение 400, 800.
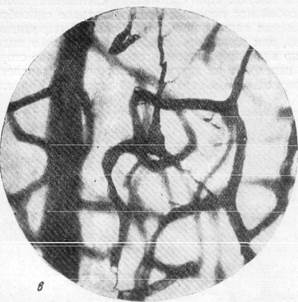
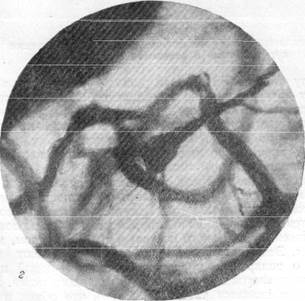
Рис. 156, в, г. Микрофотографии, иллюстрирующие расположение пирамидных клеток
коры полушарий головного мозга в капиллярной петле. Импрегнация по методу Б. Н. Клосовского. Увеличение 400 и 800.
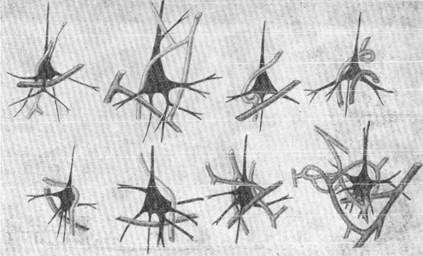
нить и расширить ее с помощью рисунка. Мы зарисовывали пирамидную клетку со всеми ее отростками и окружающие клетку капилляры при каждом повороте микрометрического винта. При этом с возможной точностью отмечались диаметры капилляров и положение капилляров в отношении нервной клетки. При сравнении сделанных таким образом рисунков между собой нас поразило исключительное однообразие в от-ношении расположения капилляров возле большой пирамидной клетки. На рис. 157 видно, как капилляр огибает тело клетки в виде опирали. При этом капилляр вначале располагается возле одной из сторон клетки, затем, изгибаясь, переходит на другую ее сторону и оставляет тело нервной клеши при переходе ее в верхушечный отросток. Капилляр плотно
|
Рис. 157. Соотношение между большими пирамидными клетками артериальными и венозными капиллярами.
коры и
приложит к телу клетки. На том же рис. 157 видно, что в основании клетки проходит другой капилляр с несколько большим по сравнению с первым диаметром. Этот капилляр идет на некотором расстоянии от тела клетки, причем часть отростков последней находится Во одну сторону капилляра, часть — по другую. Благодаря характерному расположению этого капилляра, пирамидная клетка коры головного мозга как бы лежит своим основанием на этом капилляре.
Прослеживая дальнейший ход таких капилляров, мы в некоторых случаях могли ясно видеть, что капилляр, окружающий клетку в виде спирали, является артериальным, так как он представляет собой капиллярное продолжение артерии. Капилляр, лежащий в основании клетки, является продолжением венозного сосуда и, таким образом, может быть назван венозным. Эти морфологические данные делают возможным предположение о поляркости пирамидной клетки — одной из наиболее диференцированных клеток коры полушарий головного мозга. Полярность пирамидной клетки является результатом того, что обмен в ней имеет определенную направленность. Надо думать, что участии тела пирамидной клетки, прилежащие к артериальному капилляру, представляют собой место, где происходит интенсивное поглощение кислорода.
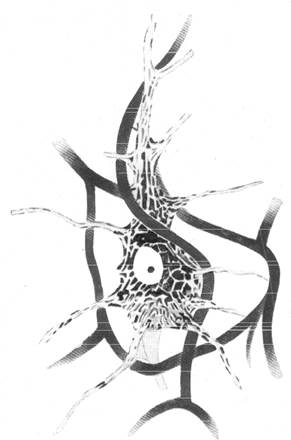
Рис. 158. Соотношение между распределением
нисслевской зернистости и пигмента в теле
большой пирамидной клетки коры и капиллярами
вокруг нее.
Напротив, в тех участках клетки, которые располагаются вблизи венозного капилляра, по всей вероятности, происходит отдача продуктов обмена веществ.
Если обратитьсяк особенностям тонного внутреннего строения большой пирамидной клетки коры больших полушарий, как оно выявляется на препаратах, окрашенных по методике Ниссля, то, согласно всем исследователям, пирамидная клетка асимметрична по своему (внутреннему строению. В качестве примера приводим рисунок (ряс. 158) большой пирамидной нервной клетки, взятый нами из руководства по неврологии с окружающими ее капиллярами, нанесенными на рисунок в соответствии с данными наших исследований. На этом рисунке видно, что нисслевская зернистость распределена в теле клетки неравномерно. Наибольшее скопление хроматиновых глыбок отмечается справа от ядра, где к тому же интенсивность окрашивания хроматиновых глыбок значительно выражена. Снизу от ядра вместо хроматина отмечается скопление пигмента липофусцина. В месте отхождения от клетки аксона конусообразное расширение тела клетки совершенно лишено и хроматиновых глыбок, и пигмента.
При сравнении расположения тигроида и липофусцина в большой пирамидной нервной клетке коры с расположением капилляров вокруг нее (рис. 157 и 158) можно видеть, что наибольшее количество нисслев-ской зернистости будет наблюдаться в местах клеток, прилежащих к артериальному капилляру.
Ближе к основанию пирамидной клетки, где сосредоточивается пигмент липофусцин, атакже находится большой участок, не содержащий ни пигмента, ни нисслевской зернистости (место отхождения аксона), проходит венозный капилляр.
Таким образом, тонкая структура пирамидной клетки коры указывает на определенную направленность процессов обмена веществ в ней. В соответствии с расположением артериального и венозного капилляров возле теша пирамидной клетки нужно думать, что обмен веществ происходит в направлении от верхушечного отростка к основанию большой пирамидной клетки коры полушарий головного мозга, т. е. в направлении импульса от дендритов к аксону. Вполне возможно предположить, что полярность и определенный способ взаимодействия с артериальной и венозной частью сосудистой сети мозгового вещества характерны только для высокодиференцированных больших пирамидных клеток.
На настоящем уровне наших знаний нельзя дать никакого определенного ответа на вопрос, существует ли полярность у тех нервных клеток, которые располагаются в одной капиллярнойпетле не в одиночку, а группами. По этому поводу можно высказать лишь общие соображения. Возможно, что и у этих клеток существует такая же полярность обмена веществ, как и у пирамидных клеток. Нет оснований, однако, отрицать наличие и другого способа обмена. Можно предполагать, что в определенный момент клетка только усваивает кислород и питательные вещества крови, тогда как в другой момент она только отдает продукты обмена веществ. Иначе говоря, в первом случае ассимиляция и диссимиляция протекают в клетке одновременно, во втором — в разное время.
Как известно, наиболее простые взаимоотношения между артериальной и венозной частью сосудистой сети существуют у тех животных, мозг которых получает кровоснабжение по анатомически конечным артериям. Мозг этих животных является чрезвычайно удобным объектом для выяснения способа взаимодействия капилляров с нервными клетками. Но решение данного вопроса возможно лишь в том случае, если
будет установлено взаимное расположение артерии и вены в пределах одной артерио-венозной единицы и расположение этих сосудов в различных единицах, К сожалению, несмотря на принципиальную важность доставленных вопросов, они не поднимались исследователями, изучавшими кровоснабжение мозга опоссума или кенгуру, и требуют дальнейшей экспериментальной разработке.Выяснение их безусловно поможет разобраться в тех сложных взаимоотношениях нервного и сосудистого компонентов нервной ткани, которые наблюдаются в мозгу более высоко организованных животных.
Важность выяснения соотношений между нервными клетками и капиллярами признают вое исследователи, занимающиеся изучением строения и функций головного мозга. Почти каждый исследователь, работающий с области кровоснабжения головного мозга, несмотря на отсутствие соответствующих методик для выявления соотношений между нервными клетками и капиллярами, считает необходимым тем или иным образом коснуться этого вопроса. Поэтому имеющиеся в литературе данные представляют собой соображения общего порядка, основывающиеся на разровненных фактах, позволяющих установить только главнейшие соотношения капиллярной сени мозга с нервными клетками.
Известно, что нора полушарий головного мозга имеет капиллярную сеть, сформированную из чрезвычайно плотно расположенных капиллярных петель. При сравнении приведенных микрофотографий (рис. 159, а, б) отчетливо выступает различие капиллярных сетей в сером и белом веществе и значительно лучшая васкуляризация первого по сравнению со вторым. Густота капиллярной сети в коре послужила поводом к предположению, согласно- которому в отдельных участках серого вещества капиллярные петли лежат так тесно друг к другу, что между ними могут пройти только отростки нервных клеток, но тела их поместиться не могут (Де Но, 1927). Однако последующие исследования показали, что, несмотря на густую капиллярную сеть, в одной капиллярной петле в мозгу животных, например, кошек, могут располагаться друг возле друга 10 и даже 16 нервных клеток. В то же время в мозгу могут быть обнаружены и такие участки, например, в locus eoeruleus, находящемся в верхне-боковой части ромбовидной ямки человека, где в значительной по размеру капиллярной петле лежит только одна нервная клетка (Пфайфер, 1928).
Какой же из двух этих основных компонентов мозга—нервная клетка или капилляр—определяет их взаимное расположение по отношению друг к другу? Рассмотрим первый ряд наблюдений, указывающих на зависимость. клеточного строения от характера кровоснабжения. В этом отношении интересны данные, сообщенные Кахалем (R. Kajai, 1929). Исследуя мозговые сосуды насекомых, Кахал нашел, что они окружены кровеносными сосудами, располагающимися по поверхности, но не проникающими вглубь ганглия. Соответственно этому нервные клетки в узле ле-жат поверхностно. Более того, ориентация нервных клеток к сосудам определяет и морфологическое оформление их, так как клетки в этих случаях униполярны. Подобные же клетки наблюдаются повсюду, где имеет место снабжение кровью только с периферии. По указанию Каха-ла, униполярный тип клеток преобладает в плотных нервных узлах не только у насекомых, но и у червей и моллюсков. Клетки того же характера составляют основную массу серого вещества шинного мозга ланцетника, лишенного внутренних кровеносных сосудов.
Иной тип нервных клеток встречается там, где имеет место проникновение сосудов с периферии внутрь нервных узлов. Так, например,
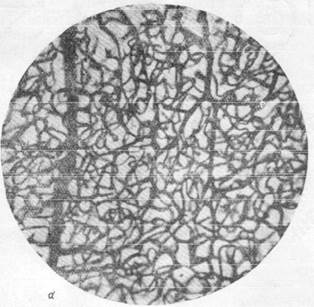
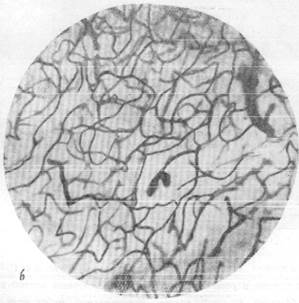
Рис. 159. Капиллярная сеть коры и белого вещества головного мозга кошки.
а — капиллярная сеть в сером веществе; б — капиллярная сеть в белом веществе.
Импрегнация по методу Б. Н. Клосовского. Увеличение 100.
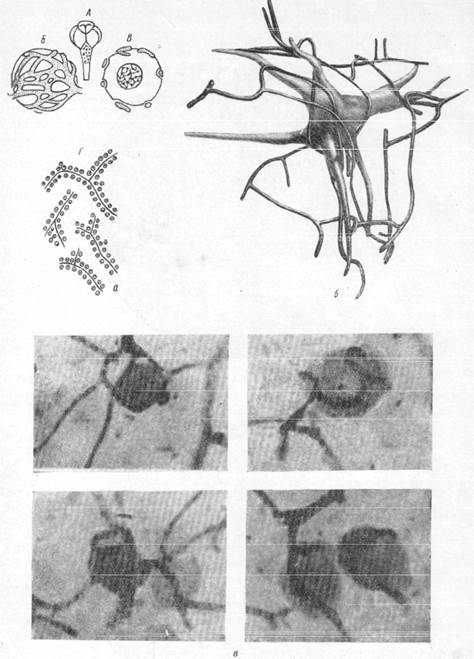
Рис. 160.
а — соотношение нервных клеток и капилляров: А — мозг акулы (Spheroides maculatus) с экстрамедуллярными нервными клетками; Б — сеть капилляров на экстрамедуллярной клетка; В — та же клетка в разрезе; Г — группировка нервных клеток вокруг сосудов в
зрительной доле каракатицы; б — соотношение большой нервной газетки ретикулярной субстанции с капиллярами
(реконструкция с препарата; увеличение 400):
в — микрофотографии, иллюстрирующие взаимоотношение нервных клеток и капилляров в мезэнцефалическом корешке тройничного нерва. Увеличение 480.
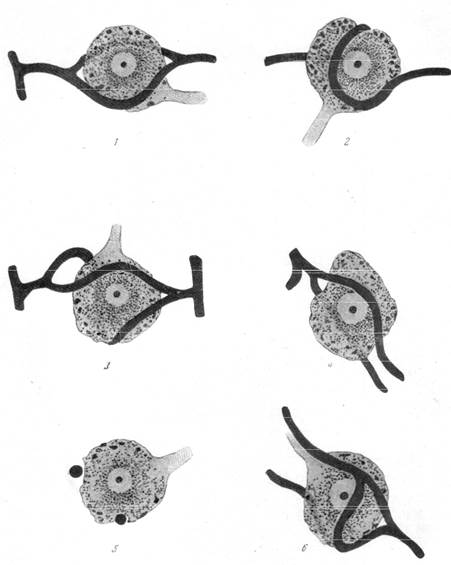
Рис. 160, г. Соотношение между нервными клетками и капиллярами в мезэнцефалическом корешке тройничного нерва.
в зрительном узле каракатицы, содержащем внутри большое количество сосудов и капилляров, клетки мультиполярны. Но и здесь можно проследить отчетливую зависимость расположения клеток от направления, в котором проходят кровеносные сосуды. Так, нервные клетки в зрительном узле каракатицы группируются вдоль разветвленийсосудистой системы (рис. 160, а —г). Сосуды представляют собой, образно говоря, оси, по обе стороны от которых лежат клетки. Количество клеток определяется диаметром сосуда. Возле центральных сосудистых стволов значительного диаметра клетки располагаются в несколько рядов, тогда как тонкие сосуды окружены одним рядом нервных клеток (Кахал, 1929; Шаррер, 1937).
Таким образом, в описанных случаях взаимное расположение клеток и сосудов определялось сосудами. Это указывает на стремление в определенных условиях нервных клеток к сосудам как к источникам питания.
Другие наблюдения показывают, что к капилляры стремятся к нервным клеткам. Подобные картины можно, например, наблюдать в некоторых вегетативных ядрах мозга, как nucleus magnooellularis praeoptieus в промежуточном мозгу рыб, и в гомологичных ядрах млекопитающих (Шаррер. 1937). Как видно на рис. 160, а, б и в, капилляры плотно прилежат к поверхности клетки, образуя как бы корзинку.
При изучении соотношения клеток и капилляров в ретикулярной субстанции продолговатого мозга сотрудники нашей лаборатории Е. Н. Космарская и Е. Г. Балашова (1950) обнаружили несколько различных способов взаимоотношений названных компонентов мозгового вещества в зависимости от величины нервных клеток. Работа велась методом прижизненной инъекции сосудистого русла трипановой синью с последующим докрашиванием нервных клеток крезилэхтвиолетом, а также нашим методом импрегнации сосудистой станки серебром.
На рис. 160, б представлена реконструкция большой нервной клетки моторного типа с расположенными возле нее капиллярами. Клетки, подобные изображенной на рис. 160, б, располагаются в ретикулярной субстанции продолговатого мозга, в области, которая то современным представлениям является местом локализации сосудодвигательного центра и имеет в длину 75 м и ширину — 35м. На рис. 160, б видно, что крупные клетки, входящие в состав сосудодвигательного центра, окружены большим количеством капилляров. Часть капилляров плотно прилежит к различным поверхностям тела клетки, проходя по ним в различных направлениях.
Тесные взаимоотношения с капиллярами обнаруживают не только тело, но и отростки больших клеток сосудодвигательного центра. Отростки в большинстве своем сопровождаются одним или чаще двумя-тремя Капиллярами, идущими вдоль отростка на некотором его протяжении. Часть отростков в месте отхождения от тела клетки оказывается обвитой капиллярами. Поскольку капилляры располагаются возле тел крупных клеток сосудодвигательного центра в различных плоскостях, фотография в значительной степени искажает действительное соотношение этих клеток с капиллярами. Поэтому при исследовании соотношения нервных клеток и капилляров Е. Н. Космарская и Е. Г. Балашева произвели реконструкцию такой клетки и окружающих ее капилляров. Вокруг клеток ретикулярной субстанции меньшего размера -от 50 до 30 м в длину - не отмечается такого большого количества капилляров, как возле описанных выше крупных клеток. Однако клетки длиной 50—30 м как в области сосудодвигательного, так и в области дыхательного центра всегда имеют один капилляр,
тесно прилежащий к какой-либо одной поверхности нервной клетки. Часть отростков нервных клеток указанных размеров в обоих центрах также на некотором своем протяжении сопровождается капиллярами. Наконец, наиболее мелкие по размерам клетки сосудодвигательного и дыхательного центров длиной 20—8 м не обнаруживают какого-либо отношения к капиллярам и располагаются свободно в крупных капиллярных петлях ретикулярной субстанции.
Контакт между нервной клеткой и капилляром может быть настолько тесным, что отдельные капилляры внедряются в протоплазму клетки и располагаются в бороздках или канавках, проходящих по поверхности тела клетки. Такого рода характерное взаиморасположение клеток и капилляров было обнаружено не только у рыб, но и у морских свинок и даже у человека. Коллин описал подобные перицеллюляр-ные капилляры в зубчатом ядре мозжечка и в вегетативных ядрах гипоталамуса. Сотрудница нашей лаборатории Е. Г. Балашева (1950) подробно проследила взаимоотношение между нервными клетками мезэнце-фалического корешка тройничного нерва и капиллярами. Характерной особенностью этих взаимоотношений является тесное прилежание капилляров к поверхности тела нервной клетки, имеющей шарообразную форму и один только отросток, а также расположение капилляров в желобке протоплазмы клетки (рис. 160, г, 5).
На микрофотографии (рис. 160, в) и на схеме (рис. 160, г) представлены разные типы взаимоотношений между нервной клеткой мезэнцефа-лического корешка и капиллярами. В ряде случаев к телу нервной клетки подходит артериальный капилляр, который, раздваиваясь, охватывает тело нервной клетки по экватору или же изгибается по двум сторонам тела клетки, затем снова соединяется в один уже венозный капилляр (рис. 160, г, 1,3,4,6). Такое разделение капилляра на два дугообразных с последующим.соединением снова в один мы неоднократно наблюдали на препаратах сосудистой сети, импрегнированной серебром по нашей методике, в коре больших полушарий и особенно в поле Брока.
В другом ряде случаев капилляр, подходя к телу клетки, охватывает его спирально, плотно прилегая к протоплазме клетки и даже частью вдавливаясь в нее (рис. 160, г, 2).
В литературе имеются указания о существовании нервных клеток, взаимодействие которых с питающим капилляром заходит так далеко, что капилляр проходит сквозь тело клетки и является, таким образом, внутриклеточным. Клетки с внутриклеточными капиллярами встречаются редко, они описаны у рыб, в поле 4 коры человека, а также в nucleus supraopticus и nucleus paraventricularis [Студничка (Studnicka), 1903; Бильшовский, 1928]. Своеобразное расположение капилляра внутри тела нервной клетки является, по мнению ряда авторов, отражением особой напряженности функциональной деятельности тех клеток, сквозь тело которых они проходят.
Мы не могли точно установить наличие внутриклеточных капилляров в центральной нервной системе и полагаем, что если они и существуют, то не могут являться результатом прорастания капилляра через тело нервной клетки. Проще представить себе, что на какой-то стадии развития капилляр располагается в непосредственной близости от поверхности тела нервной клетки, протоплазма которой при дальнейшем росте окружает капилляр со всех сторон и он, таким образом, оказывается включенным в нее.
Итак, мы видим, что в литературе существуют два взгляда на взаимоотношение нервных клеток и капилляров. Согласно первой точке зре-
тесно прилежащий к какой-либо одной поверхности нервной клетки. Часть отростков нервных клеток указанных размеров в обоих центрах также на некотором своем протяжении сопровождается капиллярами. Наконец,.наиболее мелкие по размерам клетки сосудодвигательного и дыхательного центров длиной 20—8 м не обнаруживают какого-либо отношения к капиллярам и располагаются свободно в крупных капиллярных петлях ретикулярной субстанции.
Контакт между нервной клеткой и капилляром может быть настолько тесным, что отдельные капилляры внедряются в протоплазму клетки и располагаются в бороздках или канавках, проходящих по по-верхности тела клетки. Такого рода характерное взаиморасположение клеток и капилляров было обнаружено не только у рыб, но и у морских свинок и даже у человека. Коллин описал подобные перицеллюляр-ные капилляры в зубчатом ядре мозжечка и в. вегетативных ядрах гипоталамуса. Сотрудница нашей лаборатории Е. Г. Балашева (1950) подробно проследила взаимоотношение между нервными клетками мезэнце-фалического корешка тройничного нерва и капиллярами. Характерной особенностью этих взаимоотношений является тесное прилежание капилляров к поверхности тела нервной клетки, имеющей шарообразную форму и один только отросток, а также расположение капилляров в желобке протоплазмы клетки (рис. 160, г, 5).
На микрофотографии (рис. 160, 0) и на схеме (рис. 160, г) представлены разные типы взаимоотношений между нервной клеткой мезэнцефа-лического корешка и капиллярами. В ряде случаев к телу нервной клетки подходит артериальный капилляр, который, раздваиваясь, охватывает тело нервной клетки по экватору или же изгибается по двум сторонам тела клетки, затем снова соединяется в один уже венозный капилляр (рис. 160, г, 1,3,4,6). Такое разделение капилляра на два дугообразных с последующим.соединением снова в один мы неоднократно наблюдали на препаратах сосудистой сети, импрегнированной серебром по нашей методике, в коре больших полушарий и особенно в поле Брока.
В другом раде случаев капилляр, подходя к телу клетки, охватывает его спирально, плотно прилегая к протоплазме клетки и даже частью вдавливаясь в нее (рис, 160. г, 2).
В литературе имеются указания о существовании нервных клеток, взаимодействие которых с питающим капилляром заходит так далеко, что капилляр проходит сквозь тело клетки и является, таким образом, внутриклеточным. Клетки с внутриклеточными капиллярами встречаются редко, они описаны у рыб, в поле 4 коры человека, а также в nucleus supraopticus и nucleus paraventricularis [Студничка (Studnicka), 1903; Вильнюсский, 1928]. Своеобразное расположение капилляра внутри тела нервной клетки является, по мнению ряда авторов, отражением особой напряженности функциональной деятельности тех клеток, сквозь тело которых они проходят.
Мы не могли точно установить наличие внутриклеточных капилляров в центральной нервной системе и полагаем, что если они и существуют, то не могут являться результатом прорастания капилляра через тело нервной клетки. Проще представить себе, что на какой-то стадии развития капилляр располагается в непосредственной близости от поверхности тела нервной клетки, протоплазма которой при дальнейшем росте окружает капилляр со всех сторон н он, таким образом, оказывается включенным в нее.
Итак, мы видим, что в литературе существуют два взгляда на взаимоотношение нервных клеток и капилляров. Согласно первой точке зре-
ния, нервные клетки передвигаются по направлению к сосудам и группируются в непосредственной близости от источника питания. Иначе говоря, речь идет о периваскулярном расположении нервных клеток. Согласно второй точке зрения, тело нервной клешни рассматривается как центр, вокруг которого располагаются сосуды, т. е. речь идет о перицел-л юл я рном распределении капилляров.
Как же понять существование в центральной нервной системе того и другого способа взаимодействия нервных клеток и капилляров? С первого взгляда кажется вполне заданным считать нервные клетки как вы-сокодиференцированные элементы, функции которых находятся в теснейшей зависимости от непрерывного поступления к ним кислорода и питательных веществ, центрами притяжения других элементов. Это тем более вероятно, что сосуды представляют собой результат преобразования мезенхимных элементов, обладающих функцией передвижения. Но в то же время нельзя не считаться с тем, что в ряде случаев нервные клетки определенным образом стремятся к капиллярам.
Подвергнув этот вопрос анализу с точки зрения онтогенеза, мы нашли возможным сделать предположение, объясняющее различные способы взаимоотношений нервных клеток и капилляров. В 1947 г. нами была предложена, теория, рассматривающая развитие полушарий головного мозга в филогенезе и онтогенезе в зависимости от улучшения и смены систем, питающих мозг (кровеносной и ликворной). Представление о путях морфологического развития полушарий головного мозга обосновывалось сравнением результатов наших работ о развитии сосудистых сплетений мозга, исследований по кровообращению в мозгу и по развитию сосудисто-капиллярной сети в нем и т. д. Сопоставление данных этих работ с данными о развитии и миграции нервных клеток коры полушарий головного мозга и с результатами изучения развития глиоенюй ткани дало нам понять, каким образом в онтогенезе и филогенезе происходит смена ликворного питания нервных клеток ликворно-кровя-ным, а затем и кровяным.
Мы могли констатировать, что в процессе превращения поперечника мозгового пузыря в поперечник полушария головного, мозга взаимоотношения нервных клеток и капилляров изменяются несколько раз.
На одних этапах развития нервные клетки являются центрами притяжения капилляров, на других—клетки сами мигрируют к сосудам.
На ранней стадии развития передний мозговой пузырь состоит только из многослойного, матрикса и узкого, почти не содержащего клеток краевого покрова. Кровеносная система в этот период представлена широкими капиллярами, располагающимися в мягкой мозговой оболочке на наружной поверхности переднего мозгового пузыря (рис. 161). Мат-рикс в этом периоде развития сосудов не содержит. Па стадии существования бессосудистого матрикса клетки его получают питательные вещества из ликвора, выделяемого особо построенными сосудистыми сплетениями. Вслед за этим развитие поперечника переднего мозгового пузыря характеризуется тем, что клетки матрикса Многократно делятся, благодаря чему толщина всего слоя значительно увеличивается. Одновременно с этим отмечается врастание капиллярных сосудов в матрикс и образование в нем капиллярной сети. Таким образом, большое количество клеток, образующихся при делении клеток матрикса, нуждается в притоке большего количества кислорода и питательных веществ и в более быстром выведении продуктов обмена. Можно думать, что продукты обратного метаморфоза клеток матрикса в данный период являются стимулом, под влиянием которого совершается перемещение мезенхи-
мальных элементов в виде прорастающих капилляров по направлению к матриксу,
Во время прорастания капилляров в матрикс нервные элементы его некоторое время находятся в окружении тех веществ, которые поступают из жидкости, вырабатываемой сосудистыми сплетениями, и из крови, циркулирующей по капиллярной сети матрикса. По мере роста и превращения элементов матрикса происходит качественное изменение их обмена. Изменившиеся процессы обмена веществ требуют для нормального своего течения большого количества кислорода. Однако по сравнению с большим количеством клеток, содержащихся в матриксе, капил-
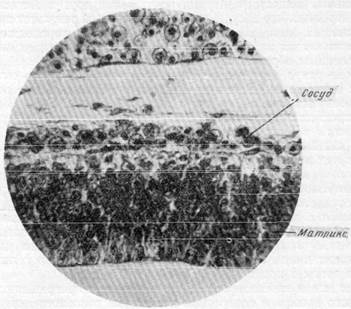
Рис. 161. Расположение кровеносных сосудов только в мягкой мозговой оболочке на ранке» стадии развития. Эмбрион крысы первой половины беременности (сагиттальный срез). Окраска по методу Массона. Увеличение 100.
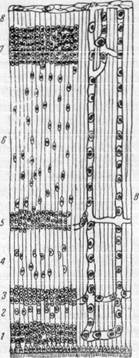
ляров на данной стадии развития мало, следствием чего и является некоторое кислородное голодание, испытываемое клетками матрикса. Последнее обстоятельство приводит к тому, что нервные элементы матрикса начинают перемещаться, мигрируют по направлению к наружной поверхности мозгового пузыря, в мягкой мозговой оболочке которого располагается густая сеть артериальных сосудов. Как можно видеть на рис. 162, передвижение клеток матрикса происходит вдоль вертикально идущих отростков спонгиобластов (по направлению от полости мозгового пузыря к его наружной поверхности).
Миграция клеток приводит к образованию сначала так называемого кахалевсюго слоя, расположенного в непосредственной близости от наружной поверхности мозгового пузыря. Кислород и питательные вещества, содержащиеся в большом количестве в крови, циркулирующей по сети артериальных сосудов мягкой мозговой оболочки, на первых этапах создают наиболее благоприятные условия существования для переместившихся клеток.
Одновременно с этим известные изменения претерпевает также и кровь. Основное изменение заключается в превращении ядерных эритроцитов в безъядерные. Благодаря этому процессы обмена веществ в самом красном кровяном шарике крови становятся значительно менее выраженными и основная масса кислорода и питательных веществ переносится ими уже не для собственного потребления (Шейнис, 1949).
|
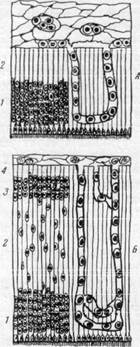
|
Рис. 162. Схема, иллюстрирующая образование коры и белого вещества полушария головного мозга.
Миграция нервных клеток и прорастание сосудов
в мозговое вещество.
А — стенка полушария головного мозга (эмбрион четырех недель): 1 — матрикс; 2 — краевой покров; Б — эмбрион середины третьего месяца: 1 — матрикс: 2 — промежуточный слой: 3 — закладка корковой пластинки; 4 — краевой покров. В — стенка полушария головного мозга на стадии 8 слоев (эмбрион 4—5 месяцев): 1 — матрикс; 2 — внутренний полосатый слой; 3 — внутренний переходный слой; 4 — наружный полосатый слой; 5 — наружный переходный слой; 6 — промежуточный слой; 7 — кора: 8 — краевой покров.
Все увеличивающаяся масса клеток, перемещающаяся к наружным частям стенки переднего мозгового пузыря, требует для своей жизнедеятельности все большего количества кислорода и питательных веществ. Вместе с тем передвижение клеток сопровождается изменением протекающих в них процессов обмена веществ, т. е. диференцировкой клеток матрикса и превращением их в различные элементы нервной ткани. Все это имеете взятое приводит к тому, что клеткам налипает нехватать того количества кислоро
 2015-05-18
2015-05-18 620
620








