Аналогичным образом образуется соединение КРF6 при взаимодействии КF и РF5,которое можно записать в виде К[РF6]. При взаимодействии сульфата меди и аммиака образуется сложное соединение
CuSO 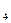 + 4NH
+ 4NH 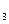 =CuSO
=CuSO 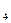 ∙ 4NH
∙ 4NH 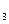 ,
,
которое выражается формулой [Cu(NH 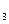 )
) 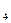 ] SO
] SO 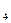 .
.
Сложные соединения, у которых имеются ковалентные связи, образованные по донорно-акцепторному механизму, получили название комплексных или координационных соединений.
Согласно координационной теории швейцарского ученого А.Вернера комплексные соединения состоят из двух сфер: внешней и внутренней.
В приведенных выше примерах внешними сферами являются К 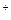 и SO
и SO 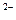
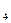 . Внутренняя сфера, называемая также комплексом, включает центральный ион или атом, вокруг которого координируются отрицательно заряженные ионы или нейтральные молекулы. При записи комплексного соединения внутреннюю сферу или комплекс заключают в скобки, например[Zn(CN)
. Внутренняя сфера, называемая также комплексом, включает центральный ион или атом, вокруг которого координируются отрицательно заряженные ионы или нейтральные молекулы. При записи комплексного соединения внутреннюю сферу или комплекс заключают в скобки, например[Zn(CN) 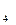 ]
] 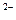 , [Zn(NH
, [Zn(NH 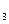 )
) 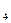 ]
] 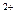 .
.
Центральный ион или атом называется комплексообразователем, а координируемые им ионы или молекулы- лиганидами. В приведенных выше примерах комплексообразователями являются ион фосфора в [PF 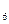 ]- и ион меди Cu
]- и ион меди Cu 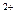 в [Cu(NH
в [Cu(NH 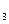 )
) 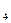 ]
] 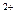 .Число монодентантных лиганидов, координируемых комплексообразовате- лем, называют координационным числом. В приведенных примерах координационное число равно соответственно 6 и 4.
.Число монодентантных лиганидов, координируемых комплексообразовате- лем, называют координационным числом. В приведенных примерах координационное число равно соответственно 6 и 4.
В зависимости от заряда различают анионные комплексы, например [PF 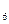 ]-,, [Zn(CN)
]-,, [Zn(CN) 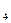 ]
] 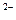 , [Al(OH)
, [Al(OH) 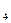 ]-, катионные комплексы, например [Cu(NH
]-, катионные комплексы, например [Cu(NH 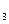 )
) 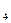 ]2+,[Ni(H
]2+,[Ni(H 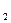 O)
O) 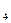 ]
] 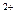 , и нейтральные комплексы, например [Ni(CO
, и нейтральные комплексы, например [Ni(CO 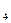 )] и [Pt(NH
)] и [Pt(NH 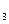 )
) 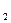 Cl
Cl 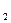 ]. Нейтральные комплексы не имеют внешней сферы. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и зарядов лигандов.
]. Нейтральные комплексы не имеют внешней сферы. Заряд комплекса численно равен алгебраической сумме заряда центрального иона и зарядов лигандов.
 2015-05-18
2015-05-18 803
803








