Полная внутренняя энергия W молекулы может быть представлена как сумма энергий электронов Wэл, колебательного движения ядер Wкол и вращательного движения Wвр молекулы как целого:
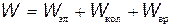 .
.
Электронная часть энергии молекулы, как и в атоме, может приобретать дискретный ряд значений: 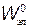 ,
, 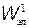 ,.... Состояние с наименьшим значением энергии
,.... Состояние с наименьшим значением энергии 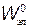 называется основным (невозбужденным). Далее следует первое возбужденное состояние с энергией
называется основным (невозбужденным). Далее следует первое возбужденное состояние с энергией 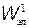 и т.д.
и т.д.
Перейдем теперь к рассмотрению энергии колебательного движения молекулы.
Каждый атом молекулы имеет три степени свободы, поэтому если молекула состоит из N атомов, то общее число степеней свободы равно 3N. Из этого числа три степени свободы приходятся на поступательное и три степени - на вращательное движения молекулы как целого. Следовательно, число колебательных степеней свободы равно 3N–6 и молекула может совершить 3N–6 различных колебаний. С хорошим приближением можно считать, что эти колебания являются гармоническими с частотами n1, n2,..., n3N-6. Энергия i-го гармонического колебания может быть выражена через частоту гармонического осциллятора формулой (см. § 30.6)
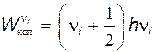 , , | (31.8) |
где ni=0, 1, 2,... — колебательные квантовые числа. Таким образом, колебательная часть энергии молекулы квантуется, т.е. может иметь ряд дискретных значений.
Вращательную энергию молекулы можно представить в виде
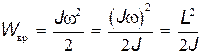 , , | (31.9) |
где J — момент инерции молекулы относительно оси, проходящей через ее центр масс; L = Jw — момент импульса. Как и для электрона в атоме (см. § 31.1), момент импульса молекулы квантуется:
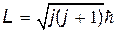 , , | (31.10) |
где j — вращательное квантовое число, принимающее значения j=0, 1, 2,....
Таким образом, вращательная энергия молекулы также квантуется, т.е. дискретна:
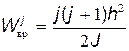 . . | (31.11) |
На основании изложенного можно заключить, что полная энергия молекулы
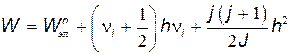
может принимать лишь дискретные значения.
Теория и опыт показывают, что расстояние между электронными уровнями энергии значительно больше расстояний между колебательными уровнями, которые, в свою очередь, значительно больше расстояний между вращательными уровнями энергии:
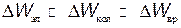 .
.
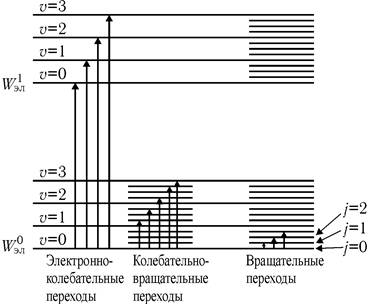
Рис. 31.5
Энергетическая схема уровней двухатомной молекулы показана на рис. 31.5, где 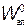 ,
, 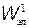 — электронные уровни; n = 0, 1, 2,... — колебательные квантовые числа (нулевой колебательный уровень совмещен с электронным); j = 0, 1, 2,... — вращательные квантовые числа.
— электронные уровни; n = 0, 1, 2,... — колебательные квантовые числа (нулевой колебательный уровень совмещен с электронным); j = 0, 1, 2,... — вращательные квантовые числа.
В общем случае при поглощении фотона энергии hn молекула может перейти в состояние с возбуждением вращательных, колебательных и электронных уровней энергии:
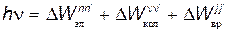 ,
,
где, например, 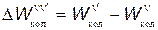 — разность энергий между колебательными уровнями n и n'.
— разность энергий между колебательными уровнями n и n'.
В миллиметровом диапазоне радиоволн энергия фотона настолько мала, что ее достаточно лишь для возбуждения вращательных уровней (DWвр ≠ 0, DWкол=0, DWэл=0). Возникает вращательный спектр, состоящий из ряда близко расположенных линий. Частоты линий этого спектра находятся из условия
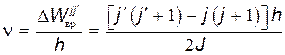 .
.
Для вращательных уровней действует правило отбора: возможны переходы только между соседними уровнями, поэтому j'=j+1. Тогда
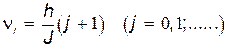 . . | (31.12) |
Измерив на опыте частоту вращательной линии спектра, можно с помощью (31.12) найти момент инерции и затем — равновесное состояние между ядрами в двухатомной молекуле или размеры более сложных молекул.
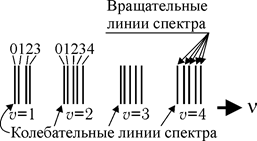 Рис. 31.6 Рис. 31.6 |
При увеличении частоты квантов становятся возможными переходы с возбуждением колебательных состояний. При этом также могут возбуждаться вращательные уровни энергии. Возникает колебательно-вращательный спектр (рис. 31.6), расположенный в инфракрасной области спектра (от 800 до 5000 нм). Этот вид спектра является полосатым: каждой полосе соответствует определенная колебательная частота, а тонкая структура полос обусловлена переходами молекулы на вращательные уровни энергии (рис. 31.6). Измерив на опыте частоты колебательных линий спектра, можно рассчитать упругие константы молекулы и определить энергию ее диссоциации.
И, наконец, в видимой и ультрафиолетовой части электромагнитного диапазона располагается электронно-колебательный спектр (DWвр ≠ 0, DWкол ≠ 0, DWэл = 0). Для его регистрации применяют приборы, где вращательная структура спектра не разрешается: в пределах одной колебательной линии происходит слияние всех вращательных линий.
Колебательная структура электронно-колебательных спектров проявляется лишь для самых простых молекул. Сложные многоатомные дают, как правило, сплошные спектры поглощения и излучения.
Спектры поглощения молекул в большинстве случаев строго индивидуальны: каждая молекула имеет свой спектр. По виду спектра можно проводить идентификацию молекул, а по его интенсивности можно определять концентрацию соответствующего вещества. Тем самым представляется возможность проводить спектральный анализ сложных химических смесей.
 2015-05-18
2015-05-18 1640
1640








