1. Влияние природы реагирующих веществ.
Природа реагирующих веществ оказывает очень существенное влияние на скорость хим. реакций. Так, например, щелочные металлы натрий и калий с одним и тем же веществом – водой реагируют с разными скоростями. Атомы калия имеют большой радиус и поэтому свои электроны отдают гораздо энергичнее, чем атомы натрия, поэтому реакция калия идет гораздо быстрее.
2. Влияние концентрации реагирующих веществ.
Пусть молекула вещества А реагирует с молекулой вещества В с образованием продукта реакции АВ в газовой смеси.
А+В=АВ
Для получения АВ из А и В необходимо, чтобы молекулы А и В прореагировали, т.е. столкнулись между собой. Без соударения вещества А В не получится.
Скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ, возведенных в степень их стехиометрических коэффициентов – это закон действующих масс.
Математический закон выражается так:
аА+вВ=сС
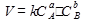
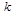 – коэффициент пропорциональности, константа скорости реакции. Коэффициент
– коэффициент пропорциональности, константа скорости реакции. Коэффициент 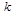 численно равен скорости реакции при концентрации каждого из реагирующих веществ равной 1моль/л, или когда произведение концентраций равно единице.
численно равен скорости реакции при концентрации каждого из реагирующих веществ равной 1моль/л, или когда произведение концентраций равно единице.
а и в – стехиометрические коэффициенты.
В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации только жидких и газообразных веществ. Концентрация твердого вещества величина постоянная, поэтому не входит в константу скорости К.
Например, для реакции горения угля:
С(тв.)+О2=СО2(газ)
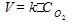
3. Влияние температуры на скорость реакции.
Зависимость скорости реакции от температуры выражается правилом Вант - Гоффа: при увеличении температуры на каждые 10°С скорости реакции возрастает в 2-4 раза.
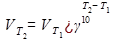
Где 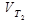 и
и 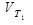 - скорости при температуре Т1 и Т2. γ - температурный коэффициент.
- скорости при температуре Т1 и Т2. γ - температурный коэффициент.
Принцип Ле Шателье — Брауна — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Ход работы:
Оборудование и реактивы: серная кислота 2% раствор (ρ=1015 Кг/м³), тиосульфат натрия 2% раствор (ρ=1005 Кг/м³), пробирки, мерные цилиндры, термометр, секундомер, стаканы.
ОПЫТ 1. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ.
Реакция тиосульфата натрия Na2S2O3 с серной кислотой протекает по уравнению:
Na2S2O3+H2SO4=Na2SO4+S↓+H2SO3
Соответствующие объемы воды серной кислоты и тиосульфата натрия отмеряем мерным цилиндром. Растворы сливаются в одну пробирку и смешиваются быстрым движением, взбалтыванием. С этого момента до начала реакции измеряется время по секундомеру. Начало реакции указывает появление в растворе мути. Опытные данные вносят в таблицу 1.
Таблица 1.
| № опыта | V(мл) H2SO4 | V(мл) Na2S2O3 | V(мл) H2O | Vобщ(мл) смеси | Время t. сек | Скорость реакции |
На основании полученных данных выразить графически зависимость скорости реакции от концентрации тиосульфата натрия.
Отложить на оси абсцисс объемы в мл тиосульфата, а на оси ординат – время в секундах.
ОПЫТ 2.ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ.
Зависимость скорости реакции от температуры должна быть показана на основании измерения времени от момента взаимодействия растворов серной кислоты и тиосульфата натрия при трех различных температурах. Во всех трех опытах концентрации и объемы растворов серной кислоты и тиосульфата натрия одинаковы.
В первом опыте в одну пробирку отмеряют 15 мл 2 % раствора тиосульфата натрия, а в другую – 5 мл 2% раствора серной кислоты. Обе пробирки опускают в стакан с горячей водой (tº~30ºС). В то же стакан опускают термометр. Спустя 5 мин. Измеряют температуру воды и, вынув из воды обе пробирки, сливают раствор серной кислоты в раствор тиосульфата натрия. Растворы смешивают быстрым взбалтыванием. С этого момента до начала реакции (появление мути) измеряется время по секундомеру.
Такие же опыты производятся с теми же объемами растворов серной кислоты и тиосульфата натрия при 40-50ºС и при охлаждении водопроводной водой.
Полученные данные вносятся в отчет по форме таблицы 2.
Таблица 2.
| № п/п | tº C | Время, сек. |
На основании полученных результатов выразить графически зависимость реакции от температуры, отложив на оси абсцисс температуры, а на оси ординат – время в секундах.
 2015-05-10
2015-05-10 766
766







