Формула воды – Н2О. Молярная масса воды – 18 г/моль.
Молекула H2O состоит из одного атома кислорода и двух атомов водорода.
Связи между атомами Н и О в молекулах ковалентные неполярные.
Для воды характерна молекулярная кристаллическая решетка.
Вода – это жидкость без цвета, запаха и вкуса, tкип = 100 °C, tпл = 0 °C, p= 2г/см3 (при 4 °С). Вода не проводит электрический ток, хорошо проводит тепло, удельная теплоемкость воды очень высокая.
(3 ошибки – ковалентные полярные связи, p = 1г/см3, плохо проводит тепло)
2 группа
Молекула воды имеет угловое строение, угол Н–О–Н составляет 104,5о.
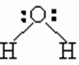
Между атомами Н и О разных молекул возникает электростатическое притяжение. Такое взаимодействие называется водородной связью, которую на схемах обозначают точками или пунктиром. Эта связь – межмолекулярная.
Водородные связи приблизительно в 20 раз более прочные, чем ковалентные. Они могут связывать три, четыре, пять, шесть молекул воды, образуя ассоциаты, имеющие б о льшие значения молекулярных масс, поэтому вода при нормальных условиях – газ. Между молекулами H2S, H2Se и H2Te водородные связи не возникают, и эти вещества при обычных условиях являются жидкостями.
Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
Если бы между молекулами воды не возникали бы водородные связи, то она имела бы температуру кипения примерно –75 °С, а температуру замерзания около – 90 °С. Но тогда вода не смогла бы стать эликсиром жизни.
(3 ошибки – связи менее прочные, вода при н.у. – жидкость, ЛВС других элементов VIА группы являются газами)
Группа
Вода - единственное вещество, которое при затвердении сжимается. Поэтому плотность льда меньше плотности жидкой воды. Вот почему лёд плавает на поверхности воды. Попробуем вообразить, как выглядел бы мир, если лёд был бы, как и полагается твёрдому веществу, плотнее жидкой воды. Зимой образовавшийся сверху лёд, как более плотный, тонул бы, непрерывно опускаясь на дно водоёма. Летом же лёд, защищённый толщей воды, не смог бы растаять. Постепенно все озёра, пруды, реки, ручьи превращались бы в гигантские ледяные гроты. Промёрзли бы моря, океаны. Наш прекрасный цветущий мир был бы сплошной ледяной пустыней, кое-где покрытой тоненьким слоем талой воды.
Данную аномалию воды можно объяснить тем, что с понижением температуры уменьшается число водородных связей между её молекулами.
Это свойство в технике доставляет определённые трудности. Например, зимой необходимо сливать воду из радиаторов автомобилей, систем водяного отопления, если они не подогреваются. При замерзании объём воды увеличивается примерно на 11%. Если такой процесс идёт в замкнутом пространстве, то возникает громадное избыточное давление, превышающее атмосферное порой в 2500 раз. В результате вода, замерзая, разрывает горные породы, дробит многотонные глыбы, не говоря уже о тонких трубах водяного отопления жилых помещений.
(2 ошибки – вода при затвердевании ниже 4оС расширяется, с понижением температуры увеличивается число водородных связей между её молекулами)
Группа
У воды самое высокое поверхностное натяжение из всех жидкостей, кроме ртути.
В отсутствие силы тяжести вода имеет форму шара, которую мы можем наблюдать при падении капель, а космонавты - в космическом корабле. Поверхность воды всегда затянута тончайшей пленкой из молекул, прочно соединенных водородными связями. Молекулы воды в поверхностном слое испытывают действие сил межмолекулярного притяжения только с одной стороны. Молекулы, находящиеся во внутренних слоях, стараются втянуть молекулы наружного слоя внутрь, и вследствие этого образуется упругая внешняя плёнка, благодаря которой некоторые предметы (стальная иголка) могут лежать на поверхности воды, слегка её прогибая. Многие насекомые (водомерки и др.) легко скользят по поверхности воды. Маленькие улитки- прудовики и катушки - ползают по внутренней стороне плёнки, как по твёрдой поверхности, в поисках пищи.
Силы поверхностного натяжения заставляют воду подниматься вверх по капиллярным каналам почвы к поверхности земли, сосудам стволов деревьев и стеблям трав.
(нет ошибок)
Группа
Среди существующих в природе жидкостей вода обладает наибольшей теплоёмкостью (способностью поглощать теплоту).
В ночное время, а также при переходе от лета к зиме вода остывает быстро. Днём или при переходе от зимы к лету она быстро нагревается. Полученное тепло вода сохраняет дольше, чем воздух и земля.
Большая удельная теплоемкость воды определяет климат планеты. Вспомните, например, водяное отопление у вас дома или «отопление» Европы теплым течением Гольфстрим. Вода смягчает колебания температуры вблизи больших водоемов. Поэтому морским обитателям не угрожает ни сильный перегрев, ни чрезмерное охлаждение.
На этом свойстве воды основан и принцип обогрева жилых помещений при движении горячей воды по батареям отопительной системы.
(2 ошибки – остывает медленно, нагревается медленно)
Группа
Вода самое распространенное вещество на Земле, мы вправе сказать, что на Земле много чистой воды. Все, что мы называем водой, - растворы тех или иных веществ в воде. Вода - один из лучших растворителей. В ней растворены газы атмосферного воздуха (азот, кислород, углекислый газ, аргон и другие), многие соли. В воде некоторых источников содержится большое количество растворенных веществ, и она имеет целебные свойства. Это минеральная вода.
Растворение веществ в воде является физическим процессом.
(2 ошибки – на Земле мало чистой воды, растворение является физико-химическим процессом)
Учитель. Ответы показывают, что к путешествию вы готовы. В добрый путь!
III. Систематизация материала.
Звуковой эффект «Корабль в море».
Учитель. Огромное число химических реакций протекает в водной среде. Впереди - станция «Реакционная среда».
Выполните задание № 3(с.119) в печатных тетрадях. (Индивидуальная работа учащихся).
Задание № 3. Используя таблицу растворимости кислот, оснований и солей, заполните схему 21 примерами формул органических и неорганических веществ.
Схема 21. Классификация веществ по растворимости в воде
| Вещества | ||||
 |  |  | ||
| Растворимые | Малорастворимые | Нерастворимые |
После выполнения задания выполняется проверка.
Учитель. Вставьте пропущенные слова и словосочетания.
1. Вода –... растворитель. Любая природная вода –....
2. Раствор –....
3. Вещества, образующие раствор, называются... раствора. Один из них – растворитель.
4. Растворение –... процесс.
5. Дробление растворяемого вещества до мелких частиц и их равномерное распределение между молекулами растворителя –....
6. Взаимодействие растворяемого вещества и растворителя –... сторона процесса растворения.
7. О химическом взаимодействии говорят такие признаки химических реакций, как…
8. Растворение … кислоты в воде протекает с … такого большого количества теплоты, что раствор может закипеть, а потому льют кислоту в воду (а не наоборот).
9. Растворение нитрата аммония сопровождается … теплоты.
10. Растворы – вещества... состава. Состав растворов выражают через....
11. Массовая доля растворенного вещества –.... Она выражается в... или....
Звуковой эффект «Корабль в море».
Учитель. Следующая станция – «Фактор диссоциации».
Выполните задание № 1(с.122) в печатных тетрадях.
Задание № 1. Устно сформулируйте определения понятий «электролит», «неэлектролит», «электролитическая диссоциация», «степень электролитической диссоциации», «кислоты», «основания», «соли».
(Фронтальная работа учащихся).
Учитель. Работая в малых группах, в ыполните задание № 2(с.122-123) в печатных тетрадях.
Задание № 2. Впишите пропущенные слова в предложения, характеризующие основные положения теории электролитической диссоциации.
1. Все вещества по их способности проводить электрический ток в водных растворах и расплавах делят на … и....
2. В растворах электролиты … (распадаются) на … и … ….
3. Причиной диссоциации электролита является его взаимодействие с молекулами …, т.е. …
4. Под действие электрического тока положительные ионы (…) движутся к катоду, а отрицательные ионы (…) – к аноду.
5. Не все электролиты в одинаковой мере диссоциируют на …. По степени электролитической диссоциации электролиты делят на … и...
6. Все свойства растворов электролитов определяются свойствами тех …, которые они образуют при ….
Учитель. Назовите основоположников ТЭД. (Ответы учащихся, демонстрация портретов С.Аррениуса, И.А. Каблукова).
Учитель. Предлагаю посмотреть анимацию «Механизм электролитической диссоциации» и в спомнить п оследовательность процессов, происходящих при диссоциации веществ с ионной и ковалентной полярной связью. (Просмотр анимации).
Учащиеся:
Последовательность процессов, происходящих при диссоциации веществ с ионной связью:
1) ориентация молекул- диполей воды около ионов кристалла;
2) гидратация (взаимодействие) молекул воды с противоположно заряженными ионами поверхностного слоя кристалла;
3) диссоциация (распад) кристалла электролита на гидратированные ионы.
Последовательность процессов, происходящих при диссоциации веществ с ковалентной полярной связью:
1) ориентация молекул - диполей воды около полюсов молекулы электролита;
2) гидратация (взаимодействие) молекул воды с молекулами электролита;
3) превращение ковалентной полярной связи в ионную;
4) диссоциация (распад) молекул электролита на гидратированные ионы.
Учитель. Самостоятельно в ыполните задание № 6(с.120) в печатных тетрадях.
(Индивидуальная работа учащихся в тетрадях, на обратной стороне доски выполняет пункты а и б этого задания один ученик, второй - пункт в).
Задание № 6. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. Допишите определения. Сформулируйте выводы.
а)KOH, Ca(OH)2, LiOH, Fe(OH)2.
Основания – это электролиты, которые диссоциируют на катионы …(индивидуальное) и …- анионы (общее). Все общие свойства растворимых оснований (…): мылкость на ощупь, изменение окраски индикатора и другие обусловлены….
б) HNO3, H2SiO3, H3PO4, H2S.
Кислоты – это электролиты, которые диссоциируют на катионы …(общее) и анионы … (индивидуальное). Все общие свойства растворов кислот: кислый вкус, изменение окраски индикатора и другие обусловлены….
в) NaCl, BaSO4, NH4NO3, Fe(NO3)2, CaCO3, Fe2(SO4)3, Cu(NO3)2, K2SiO3.
Соли – это электролиты, которые диссоциируют на катионы … или … и …анионы …. ….
Учитель. Выполните задание № 4(с.123-124) в печатных тетрадях.
(Индивидуальная работа учащихся в тетрадях с последующей проверкой).
Задание № 4. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы:
а) сильных электролитов
| CH3COOK | CaCO3 | H2CO3 |
| CH3COOH | HCl | LiOH |
| CaCl2 | HNO3 | Ba(NO3)2 |
б) слабых электролитов
| H3PO4 | BaSO4 | NaOH |
| NH3· H2O | H2S | Cu(OH)2 |
| (NH4)2SO4 | HNO3 | Ba(OH)2 |
Учитель. Прежде чем перейти к следующей станции, предлагаю немного отдохнуть и провести физкультурную минутку.
Упражнения для гимнастики глаз:
1) В ПСХЭ найдите глазами элемент, атомы которого образуют простое вещество, с помощью которого обеззараживают воду. Сколько вариантов ответа может быть? (Кислород и хлор)
2) Переведите свой взгляд на элемент, атомы которого образуют простое вещество, в котором горит вода. (Фтор)
3) Переведите свой взгляд на элемент, атомы которого входят в состав оксида, который гасится водой. (Кальций)
4) Переведите свой взгляд на элемент-металл 3 периода, атомы которого образуют простое вещество, энергичнее всех взаимодействующее с водой.(Натрий)
5) Переведите свой взгляд на элемент-неметалл IVА группы, атомы которого входят в состав кислотного оксида, нерастворимого в воде. (Кремний)
Упражнения для снятия утомления с плечевого пояса и рук:
И.п. – стоя, кисти тыльной стороной на поясе. 1-2- свести локти вперёд, голову наклонить вперёд. 3 - 4-локти назад, прогнуться. Повторить 6 раз. Затем руки вниз и потрясти расслабленно. Темп медленный.
Звуковой эффект «Корабль в море».
Учитель. Посмотрите видеофрагмент «Получение йодида алюминия» и назовите следующую станцию. (Просмотр видеофрагмента).
Ученики. Станция «Катализатор».
Учитель. Какие вещества называют катализаторами? Запишите уравнение реакции получения йодида алюминия. Дайте характеристику реакции по всем изученным признакам классификации. Разберите её с точки зрения окисления-восстановления. (Фронтальная работа у доски).
Звуковой эффект «Корабль в море».
Учитель. Значительна роль воды для транспортировки веществ в сферу реакции. Следующая станция – «Транспорт веществ».
Как вы уже знаете, особенно важна вода для живых организмов, так как все жидкие среды живых организмов более чем на 90-98 % состоят из воды.
Послушав выступление, вы ещё раз убедитесь, что выполнение одной функции немыслимо без выполнения других, всё взаимосвязано. Составьте несколько вопросов по содержанию выступления, затем мы их обсудим.
 2015-05-18
2015-05-18 1477
1477
