Фотолюминесценцией принято называть свечение вещества, возникшее при переходе его молекул из возбужденного электронного состояния в основное, если возбуждение осуществляется путем поглощения квантов электромагнитного излучения оптического диапазона.
В зависимости от природы энергетических уровней, участвующих в формировании излучения, фотолюминесценция подразделяется на флуоресценцию и фосфоресценцию. Флуоресценция возникает в результате оптического перехода между двумя уровнями одинаковой мультиплетности (как правило, между первым возбужденным S 1 и основным S 0 синглетными
состояниями молекулы) и характеризуется высокой вероятностью спонтанного перехода – малым временем жизни τ электронно- возбужденного синглетного состояния S 1. Фосфоресценция в отличие от флуоресценции обусловлена оптическими переходами между уровнями разной мультиплетности (обычно между нижним возбужденным триплетным T 1 и основным синглетным S 0 состояниями молекулы) и отличается весьма малой вероятностью перехода (большим временем жизни триплетного возбужденного состояния T 1).
В общем случае возбужденные молекулы теряют избыток энергии не только за счет радиационных переходов, но и безызлучательным путем. Безызлучательные переходы между электронными состояниями одной и той мультиплетности принято называть внутренней конверсией, а между состояниями разной мультиплетности – интеркомбинационной конверсией.
Поглощение и испускание света хорошо иллюстрирует диаграмма уровней энергии, предложенная Яблонским (рис.2).
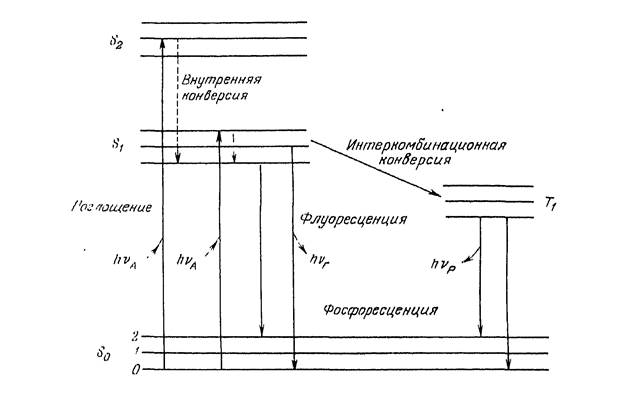
Рис. 2. Диаграмма Яблонского
Основное, первое и второе электронные состояния обозначают S 0, S 1 и S 2 ,соответственно. Каждый из этих уровней энергии может состоять из множества колебательных энергетических уровней, обозначаемых 0, 1, 2 и т. д. Переходы между различными электронными уровнями обозначены вертикальными линиями. Такое представление используется, чтобы наглядно показать мгновенную природу поглощения света. Этот процесс происходит примерно за 10-15 с, время, слишком короткое для заметного смещения ядер (принцип Франка-Кондона). 3а поглощением света обычно следует несколько других процессов. Возбуждение флуорофора, как правило, происходит до нeкoтopoгo высшего колебательного уровня состояний (S 1 или S 2). 3а некоторыми редкими исключениями. для молекул в конденсированной фазе характерна быстрая релаксация на самый нижний колебательный уровень состояния S 1. Этот процесс называется внутренней конверсией и происходит большей частью за 10-12 с. Поскольку типичные времена затухания флуоресценции близки к 10-8 с. Внутренняя конверсия обычно полностью заканчивается до процесса испускания. Следовательно, испускание флуоресценции чаще всего осуществляется из термически paвновecнoгo возбужденного состояния. Аналогично поглощению обратный переход электронов на самый нижний электронный уровень также приводит к колебательно возбужденному состоянию (рис. 2). Термическое равновесие достигается за время порядка 10-12 с. В большинстве случаев электронное возбуждение не сильно изменяет расположение колебательных уровней
энергии. В результате этого, колебательные структуры, проявляющиеся в
спектрах поглощения и испускания сходны (рис.3).
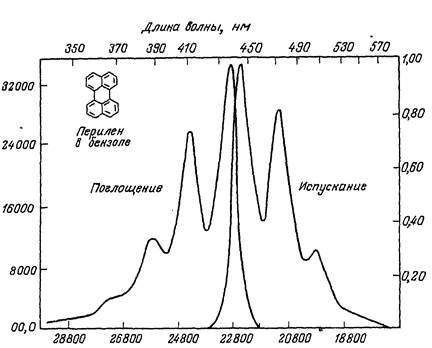
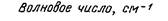
РИС. 3. Спектры поглощения и испускания флуоресценции перилена в бензоле.
Молекулы в состоянии S1 могут также подвергаться конверсии в первое триплетное состояние Т1. Испускание из Т1, называемое фосфоресценцией
Обычно сдвинуто в сторону больших длин волн (меньших энергий) по сравнению с флуоресценцией. Конверсия из S1 в Т1 называется интеркомбинационной конверсией. Переход из Т1 в основное состояние запрещен, в результате чего константа скорости тaкoгo испускания на несколько порядков меньше соответствующей константы для флуоресценции. На испускание флуоресценции мoгут влиять и другие факторы, не показанные в явном виде на рис. 2: влияние растворителей, релаксация растворителя, тушение, а также реакции, происходящие в возбужденных состояниях.
1.3. Времена затухания и квантовые выходы флуоресценции
Все процессы возбуждения можно охарактеризовать константами скоростей соответствующих процессов –
Kфл,Кик, Квн, Кбез
Длительность пребывания молекул в возбужденном состоянии определяется естественным (радиационным) τ0 и реальным τ временем жизни уровня.
Реальное время жизни τ определяется вероятностью всех процессов, уменьшающих заселенность возбужденного состояния, т.е.
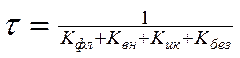 ,
, 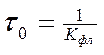
Важнейшей характеристикой флуоресценции является ее квантовый выход. Квантовый выход Q –отношение числа фотонов Nис, испускаемых единицей объема вещества в единицу времени, к числу поглощенных фотонов
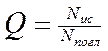
Квантовый выход связан с константой скорости затухания флуоресценции и константами скорости безызлучательных переходов следующим образом:
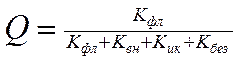
Молекулярная флуоресценция имеет ряд особенностей:
1.В конденсированной среде исходным для испускания уровнем обычно является самый нижний возбужденный уровень данной мультиплетности (правило Каша), поскольку для переходов между возбужденными состояниями самым вероятным является процесс внутренней конверсии. Вследствие этого положение полос флуоресценции, как правило, не зависит от того, какой из полосы поглощения соответствует возбуждающий свет.
2.Полоса флуоресценции смещена относительно длинноволновой полосы поглощения в области более низких энергий (больших длин волн)
(закон Стокса, рис.3).
3. Контуры полос поглощения и флуоресценции, приближенно симметричны относительно вертикали, которая проходит через точку их пересечения (правило вертикальной симметрии Левшина, рис.3). Нередко, однако, это правило не выполняется.
Цель работы: практическое освоение аппаратуры и методов флуориметрического анализа красителей.
Приборы, принадлежности и реактивы
1) Спектрофлуориметр Shimadzu RF-5301 (рис.4).
2) Кварцевая кювета с длиной оптического пути 1 см.
3) Раствор родамина G.
4) Пипетка

Рис.4. Общий внешний вид спектрофлуориметра Shimadzu RF-5301
 2015-05-10
2015-05-10 2424
2424








