Идеальный газ описывается уравнением Менделеева-Клапейрона
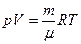 (4.1)
(4.1)
которое связывает макропараметры газа – давление p, объем V и температуру T. Если учесть, что масса газа m равна произведению числа молекул N в данном объеме V на массу одной молекулы m 0,
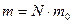 (4.2)
(4.2)
а масса одного моля
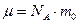 (4.3)
(4.3)
где N A - число Авогадро; то уравнение (4.1) принимает вид:
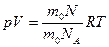
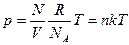 (4.4)
(4.4)
где 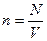 – количество молекул в единице объема,
– количество молекул в единице объема, 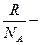 постоянная Больцмана (
постоянная Больцмана (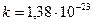 Дж/К)
Дж/К)
Эти уравнения, однако, не содержат физических величин, характеризующих свойства молекул, микропараметры газа (массу молекулы m 0, среднюю квадратичную скорость 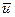 или кинетическую энергию молекулы E). В молекулярно-кинетической теории газа выводится основное уравнение молекулярно-кинетической теории, связывающее микро- и макропараметры газа:
или кинетическую энергию молекулы E). В молекулярно-кинетической теории газа выводится основное уравнение молекулярно-кинетической теории, связывающее микро- и макропараметры газа:
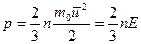 (4.5)
(4.5)
где E - средняя кинетическая энергия молекул. Если сравнить(4.5) и (4.4), то получим 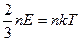 или
или
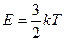 (4.6)
(4.6)
Эта формула справедлива для одноатомной молекулы с тремя степенями свободы, а в общем случае 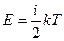 , где i - количество степеней свободы. Из (4.6) можно определить среднюю квадратичную скорость молекулы
, где i - количество степеней свободы. Из (4.6) можно определить среднюю квадратичную скорость молекулы
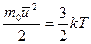
откуда
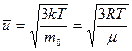 (4.7)
(4.7)
Важными микропараметрами газа является эффективный диаметр молекул d и средняя длина свободного пробега 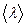 – расстояние, которое пролетает молекула, двигаясь прямолинейно между последовательными столкновениями. Последняя величина может быть найдена как среднее арифметическое расстояний между соседними столкновениями
– расстояние, которое пролетает молекула, двигаясь прямолинейно между последовательными столкновениями. Последняя величина может быть найдена как среднее арифметическое расстояний между соседними столкновениями  (рис. 4.1).
(рис. 4.1).
Рисунок 4.1 – Схема столкновений молекул
Если за одну секунду молекула претерпевает Z столкновений, то
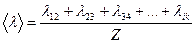
а пройденный при этом путь 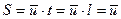 , тогда
, тогда
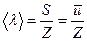 (4.8)
(4.8)
Число столкновений Z в секунду равно числу молекул, попавших внутрь ломаной трубки радиусом, равным диаметру молекул d, причем заломы ее соответствуют точкам столкновений молекул (рис 4.2). Площадь сечения этой трубки πd2, а длина ее при t =1c равна 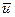 . Тогда ее объем образованный за 1 с, будет πd2
. Тогда ее объем образованный за 1 с, будет πd2 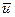 , а количество молекул, попавших внутрь и претерпевших столкновения с новой рассматриваемой центральной молекулой, равно
, а количество молекул, попавших внутрь и претерпевших столкновения с новой рассматриваемой центральной молекулой, равно 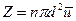 . Однако с учетом движения всех молекул это число увеличивается в среднем в
. Однако с учетом движения всех молекул это число увеличивается в среднем в 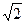 раз и действительное значение
раз и действительное значение
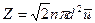 (4.9)
(4.9)
Подставив (4.9) в (4.8), получим
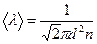 (4.10)
(4.10)
а используя (4.4)
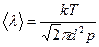 (4.11)
(4.11)
то есть 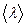 ~
~ 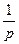 .Таким образом, с уменьшением давления p средняя длина свободного пробега увеличивается и при некотором давлении p для данного газа
.Таким образом, с уменьшением давления p средняя длина свободного пробега увеличивается и при некотором давлении p для данного газа 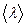 станет соизмеримой с размерами l сосуда, в котором находится газ, то есть
станет соизмеримой с размерами l сосуда, в котором находится газ, то есть 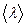 ~ l.
~ l.
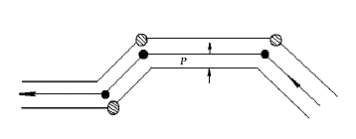
Рисунок 4.2 – Схема для расчета числа столкновений Z молекул за секунду
В этом случае молекула может пролететь от одной стенки сосуда до другой без соприкосновения с другими молекулами; такое состояние газа в физике называют состоянием среднего вакуума, например, при давлении p 1,5·10 -4 мм рт.ст. и размерах сосуды l 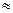 1м будем иметь средний вакуум. Если
1м будем иметь средний вакуум. Если 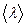 >> l, то говорят о высоком вакууме, а при
>> l, то говорят о высоком вакууме, а при 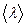 < l – о низком.
< l – о низком.
Из формулы (4.11) можно определить 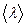 , зная d и p, однако определение опытным путем d представляет известные трудности, и в данной работе мы сначала определяем
, зная d и p, однако определение опытным путем d представляет известные трудности, и в данной работе мы сначала определяем 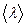 из формулы связывающей коэффициент вязкости η, плотность газа ρ,
из формулы связывающей коэффициент вязкости η, плотность газа ρ, 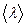 и
и 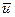 .
.
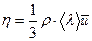 (4.12)
(4.12)
Это уравнение получается при рассмотрении обмена количеством движения между движущимися слоями газа. Из (4.1) получим, что 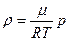
и окончательно, используя (4.7) и (4.12), получим
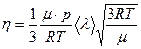 (4.13)
(4.13)
Из формулы Пуазейля для объема V газа, который вытекает из трубки длиной x и радиусом r за время τ под действием разности давлений на концах трубки Δ p, можно выразить
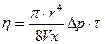 (4.14)
(4.14)
Приравнивая (4.14) и (4.13), получим
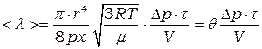 (4.15)
(4.15)
где
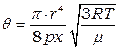 (4.16)
(4.16)
является постоянной величиной в наших исследованиях.
 2015-05-10
2015-05-10 400
400








