Твердыми телами называются тела, у которых форма и объем постоянны. Твердые тела по своим физическим свойствам разделяются на тела: 1) кристаллические и 2) аморфные.
Кристаллы – твердые тела, имеющие правильное периодическое расположение составляющих их частиц. Кристаллы ограничены плоскими гранями, сходящимися в ребрах и вершинах.
Аморфными веществами называются вещества, не обладающие в конденсированном состоянии кристаллическим строением. Аморфными веществами являются: неорганические стекла, плавленый кварц (пористые аморфные вещества), каучук, резина, органические стекла, смолы (высокополимерные соединения).
Кристаллические тела анизотропны, т.е. их физические свойства (упругость, теплопроводность, электропроводность) по различным направлениям неодинаковы.
Тела, свойства которых одинаковы по всем направлениям, называются изотропными. Изотропными телами являются: газы, почти все жидкости и аморфные тела. Причиной анизотропией служит упорядоченное расположение частиц вещества: атомов, молекул, ионов, из которых они состоят. Упорядоченность расположения частиц кристалла заключается в том, что частицы вещества размещаются в узлах геометрически правильной пространственной решетки.
Твердые тела, кристаллическая структура которых обнаруживается непосредственно по их внешней форме, называются монокристаллами. Монокристаллы имеют форму правильных многогранников. Большинство твердых тел, в том числе и металлы, существуют в виде поликристаллов, т.е. имеют мелкокристаллическую структуру. Поликристаллы состоят из большого числа сросшихся мелких, хаотически расположенных отдельных кристалликов, которые называют кристаллитами, или зернами. Размеры таких зерен в металле порядка 10-5 – 10-3 см, зависят от способа получения и обработки металла.
Взаимное расположение и ориентация отдельных кристаллитов в поликристаллическом веществе обычно хаотическое и поэтому поликристаллы (в размерах больших кристаллов) являются изотропными.
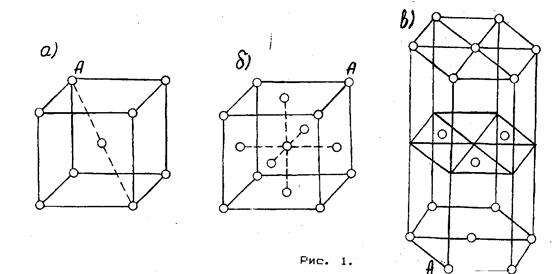
Металлы являются поликристаллами, Тип кристаллической решетки у металлов и соответственно тип кристалла называется металлическим. Во всех узлах металлического кристалла расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, которые отцепились от атомов при образовании ионов. Эти электроны играют роль «цемента», удерживая вместе положительные ионы.
Большинство металлов имеет вид решеток, показанных на рисунке 14.1: (а - кубическая объемно-центрированная, б - кубически гранецентрированная, в - плотная гексагональная).
Для характеристики тепловых свойств химически простого твердого кристаллического тела вводится понятие теплоемкости. Теплоемкостью твердого тела называется количество теплоты, полученное телом при нагревании его на 10С.
Различают удельную теплоемкость, молярную и атомную.
Удельная теплоемкость С характеризует количество теплоты, выраженное в джоулях, которое необходимо сообщить 1 кг твердого кристаллического тела, чтобы изменить его температуру на 1 градус.
Молярная теплоемкость С 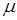 измеряется количеством теплоты, выраженным в джоулях, которое необходимо сообщить 1 молю химически простого твердого кристаллического тела, чтобы изменить его температуру на 1 градус.
измеряется количеством теплоты, выраженным в джоулях, которое необходимо сообщить 1 молю химически простого твердого кристаллического тела, чтобы изменить его температуру на 1 градус.
Атомная теплоемкость характеризует теплоемкость одного килограмм-атома вещества.
Молярная (С 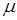 ) и удельная С теплоемкости связаны между собой следующим соотношением:
) и удельная С теплоемкости связаны между собой следующим соотношением:
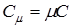 или
или 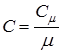 (14.1)
(14.1)
где 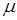 - молярная масса химически простого твердого кристаллического тела.
- молярная масса химически простого твердого кристаллического тела.
Частица, располагающаяся в узле кристаллической решетки, беспорядочно колеблется около какого-то среднего положения и обладает запасом кинетической анергии 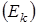 , обусловленной наличием скорости у частиц, и запасом потенциальной анергии
, обусловленной наличием скорости у частиц, и запасом потенциальной анергии 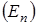 , обусловленной проявлением между частицами сил притяжения и сил отталкивания, имеющих электрическую природу. Колебания происходят ангармонично. При повышении температуры кристалла увеличивается энергия теплового движения, т.е. растет амплитуда колебания частиц.
, обусловленной проявлением между частицами сил притяжения и сил отталкивания, имеющих электрическую природу. Колебания происходят ангармонично. При повышении температуры кристалла увеличивается энергия теплового движения, т.е. растет амплитуда колебания частиц.
Если бы колебания частиц происходили строго гармонично, то увеличение амплитуды не привело бы к изменению среднего расстояния между частицами. Вследствие ангармонических колебаний частиц расстояния между ними меняются. При сближении частиц силы притяжения и силы отталкивания несимметричны (рисунок 14.2).
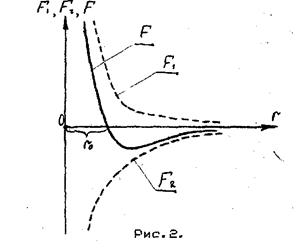
F1 - сила отталкивания;
F2 - сила притяжения;
F - результирующая сила взаимодействия;
r0 - расстояние, накотором F1 и F2 взаимно уравновешиваются.
Из рисунка 14.2 видно, что силы отталкивания при уменьшении расстояния между частицами растут много быстрее, чем силы притяжения. Это приводит к тому, что при увеличении температуры рост сип отталкивания между частицами тела преобладает над силами притяжения и тела расширяются.
Средняя энергия частицы 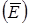 складывается из кинетической и потенциальной
складывается из кинетической и потенциальной 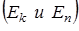 . При этом на каждый вид энергии приходится одинаковое ее количество
. При этом на каждый вид энергии приходится одинаковое ее количество 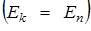 .
.
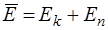 , (14.2)
, (14.2)
т.к. 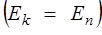 , то
, то
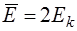 . (14.3)
. (14.3)
Тепловое движение частиц в узлах кристаллической решетки, в основном, сводится к их колебаниям около положения равновесия. Каждое колебательное движение можно разложить на три прямолинейных колебаний вдоль трех координатных осей. Поэтому следует считать, что колеблющиеся частицы твердого тела имеют три степени свободы.
По классической теории теплоемкости, на одну степень свободы движения частицы, независимо от того, будут они поступательными, вращательными или колебательными, приходится энергия 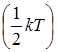 . Следовательно, запас кинетической энергии частицы с i степенями свободы движения равен
. Следовательно, запас кинетической энергии частицы с i степенями свободы движения равен
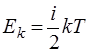 .
.
Т.к. i = 3, то
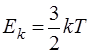 . (14.4)
. (14.4)
Тогда с учетом (14.3) и (14.4), среднее значение энергии одной частицы
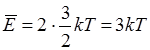 (14.5)
(14.5)
где T - температура вещества;
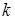 =1,38 10-23 Дж/К - постоянная Больцмана.
=1,38 10-23 Дж/К - постоянная Больцмана.
Натакую величину изменяется энергия частицы (атома, иона, молекулы) при изменении температуры тела (вещества) на один градус.
Один килограмм-атом любого вещества содержит столько же атомов, сколько в 1 моле вещества содержится молекул, т.е. число Авогадро (N0) частиц, каждая из которых обладает средней энергией 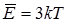 , тогда полная внутренняя энергия 1 моля (одного килограмм-атома или одной килограмм-молекулы) химически чистого простого твердого вещества составляет:
, тогда полная внутренняя энергия 1 моля (одного килограмм-атома или одной килограмм-молекулы) химически чистого простого твердого вещества составляет:
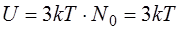 (14.6)
(14.6)
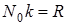 , где
, где 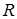 = 8,31 Дж/моль К - универсальная газовая постоянная.
= 8,31 Дж/моль К - универсальная газовая постоянная.
Согласно (14.6) внутренняя анергия одного моля химически простого твердого кристаллического тела при температуре T1 будет равна 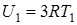 , при температуре T2 равна
, при температуре T2 равна 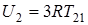 .
.
По определению молярной теплоемкости
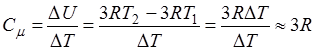 (14.7)
(14.7)
Таким образом
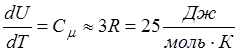 (14.8)
(14.8)
- молярная теплоемкость всех химически простых кристаллических твердых тел приблизительно равна 25 Дж/моль К.
Это утверждение носит название закона Дюлонга-Пти, которыйбыл установлен опытным путем в 1819 году.
Т.к. коэффициенты объемного расширения у твердых тел невелики, то молярные теплоемкости 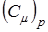 и
и 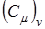 твердых тел при постоянном объеме и постоянном давлении практически не различаются. Поэтому вводят понятие только молярной теплоемкости, неуказывая, при каких условияхона определяется.
твердых тел при постоянном объеме и постоянном давлении практически не различаются. Поэтому вводят понятие только молярной теплоемкости, неуказывая, при каких условияхона определяется.
Закон Дюлонга-Пти достаточно хорошо выполняетсяпри комнатных температурах. Отклонения от этого закона для низких и высоких температур объясняются тем, что не учтено: квантование энергии колебательного движения и то, что в кристалле вследствие взаимодействия между частицами возникают гармонические упругие волны, имеющие, различные частоты.
Однако значения 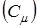 зависят от температуры и свойств кристаллов. При понижении температуры теплоемкость кристаллов быстро убывает и при приближении к абсолютному нулю становится крайне малой. Эйнштейн объяснил это явление, применив квантовую теорию. Дебай установил, что при очень низких температурах внутренняя энергия грамм-атома кристаллического тела пропорциональна четвертой степени абсолютной температуры, т.е.
зависят от температуры и свойств кристаллов. При понижении температуры теплоемкость кристаллов быстро убывает и при приближении к абсолютному нулю становится крайне малой. Эйнштейн объяснил это явление, применив квантовую теорию. Дебай установил, что при очень низких температурах внутренняя энергия грамм-атома кристаллического тела пропорциональна четвертой степени абсолютной температуры, т.е.
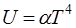 ,
,
где 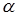 - постоянный коэффициент.
- постоянный коэффициент.
По определению атомной теплоемкости
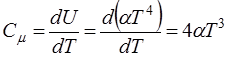 (14.9)
(14.9)
- закон Дебая.
Характеристическая температура 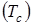 , ниже которой закон Дюлонга-Пти не выполняется, определяется по Формуле Дебая:
, ниже которой закон Дюлонга-Пти не выполняется, определяется по Формуле Дебая:
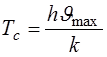 (14.10)
(14.10)
где 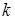 - постоянная Больцмана;
- постоянная Больцмана;
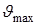 - наибольшая частота колебаний частиц в узле кристаллической решетки;
- наибольшая частота колебаний частиц в узле кристаллической решетки;
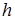 =6,625×10-34 Дж×с - постоянная Планка.
=6,625×10-34 Дж×с - постоянная Планка.
Используя соотношение между 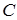 и
и 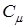 легко получить формулу для теоретического расчета удельной теплоемкости твердого тела (С):
легко получить формулу для теоретического расчета удельной теплоемкости твердого тела (С):
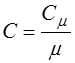 ;
; 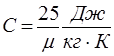 (14.11)
(14.11)
В задачу данной лабораторной работы входит определение удельной теплоемкости меди, алюминия, железакалориметрическимметодом, основанным на уравнивании теплового балансаи сравненииполучаемых результатов с теоретически рассчитаннымиданными, получаемыми по формуле (14.11).
Опустим однородный цилиндр массой 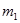 в кипящую воду и будем нагревать в течение 10 мин, при этом цилиндр приобретает температуру кипящей воды
в кипящую воду и будем нагревать в течение 10 мин, при этом цилиндр приобретает температуру кипящей воды 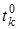 . Быстро (чтобы свести к минимуму потери тепла в окружающую среду - помещение) перенести нагретое тело и опустить во внутренний сосуд калориметра, наполненный холодной водой (
. Быстро (чтобы свести к минимуму потери тепла в окружающую среду - помещение) перенести нагретое тело и опустить во внутренний сосуд калориметра, наполненный холодной водой (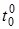 ). Тепло от нагретого цилиндра будет передаваться воде, калориметру и термометру.
). Тепло от нагретого цилиндра будет передаваться воде, калориметру и термометру.
Количество тепла, отданное цилиндром, определяется по Формуле:
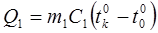 (14.12)
(14.12)
Количество тепла, полученное водой, калориметром и термометром:
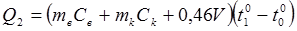 (14.13)
(14.13)
где 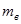 - масса воды в сосуде, помещенном в калориметре;
- масса воды в сосуде, помещенном в калориметре;
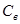 - теплоемкость воды;
- теплоемкость воды;
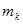 - масса внутреннего сосуда калориметра;
- масса внутреннего сосуда калориметра;
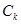 - удельная теплоемкость калориметра;
- удельная теплоемкость калориметра;
0,46 V - количество тепла, расходуемого на нагрев ртутного шарика термометра;
V - объем шарика термометра. Объем V ртутного шарика термометра определяется посредством мензурки объемом 10 см3. Погружается в воду только шарик.
Пренебрегая потерей тепла в окружающий воздух при опускании нагретого тела в воду калориметра, составим уравнение теплового баланса:
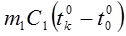 =
= 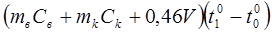 (14.14)
(14.14)
Выразим отсюда удельную теплоемкость вещества, из которого изготовлен цилиндр:
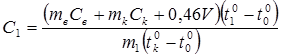 . (14.15)
. (14.15)
Подготовка и проведение измерений:
1. Налить воду в металлический стакан чуть больше половины и поставить его на включенную в сеть электроплитку.
2. Взвесить на технических весах исследуемый цилиндр 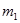 , внутренний сосуд калориметра
, внутренний сосуд калориметра 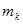 , массу налитой в него воды
, массу налитой в него воды 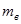 . Результаты занести в таблицу 14.1.
. Результаты занести в таблицу 14.1.
3. Опустить в горячую воду цилиндр, довести воду до кипения и греть 10-15минут. Температура (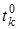 ) определяется по формуле, учитывая барометрическое давление (в мм.рт.ст.):
) определяется по формуле, учитывая барометрическое давление (в мм.рт.ст.):
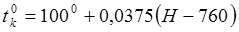 .
.
4. Измерить термометром с точностью до 0,10С температуру воды во внутреннем сосуде калориметра 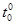 за несколько минут до опускания испытываемого тела.
за несколько минут до опускания испытываемого тела.
5. После прогревания цилиндра быстро перенести его в сосуд с водой в калориметре. Осторожно помешивая воду термометром, дождаться, когда температура установится, записать показания термометра. Занести результат в таблицу 14.1.
Таблица 14.1
| № п/п | Исследуемый образец | 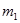 кг
кг
| 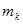 кг
кг
| 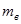 кг
кг
| 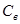
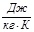
| 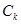
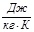
| 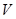 м3
м3
| 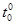 К
К
| 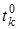 К
К
| 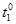 К
К
| 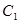
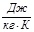
|
6. Тоже проделать с другими образцами.
7. Пользуясь уравнением теплового баланса, вычислить удельную теплоемкость образцов по формуле(14.15).
8. Вычислить удельные теплоемкостиданных образцов теоретически, используя формулу (14.11).
9. Сравнить значения удельной теплоемкости образцов,полученных теоретически и методом косвенных измерений.
Дополнительные данные:
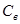 = 500
= 500 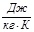 ;
;
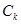 = 4190
= 4190 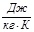 ;
;
V=2,90136×10- 4 (см3).
Вопросы для самоконтроля:
1. Какие свойства твердых тел характеризует теплоемкость?
2. Виды теплоемкости и их определение. Связь между ними.
3. Чему равна внутренняя энергия одного моля химически простого твердого тела (вещества)?
4. Закон Дюлонга-Пти.
5. Физический смысл характеристической температуры.
6. Зависимость удельной теплоемкости от температуры. Формула Дебая.
7. Формула для теоретического расчета удельной теплоемкости твердого тела.
8. Записать уравнение теплового баланса для данногоопыта.
9. Экспериментальное определениеудельной теплоемкости химическипростого твердого вещества.
10. Вычислить на основании закона Дюлонга и Пти удельные теплоемкости меди и железа.
Литература
1. Савельев И.В. Курс общей Физики. М.; Наука, 1982, - С. 158-166.
2. Рышкевич П.И. Курс Физики. М.; Высшая школа, 1975.
3. Майсова И.Н. Практикум по курсу общей физики, М.;Высшая школа, 1970.
4. Фриш и Тиморева. Курс общей Физики. 1962.- Т. 1.- С.436.
 2015-05-10
2015-05-10 681
681







