(РЕДОКС—ЭЛЕКТРОДЫ)
Простым примером редокс—электрода может служить платина, опущенная в раствор, содержащий FeCl2 и FeCl3. При сочетании такого электрода с другими происходит окисления ионов Fe2+ в Fe3+ или восстановление Fe3+ в Fe2+: 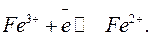
В сущности, отличие такого электрода от рассмотренных заключается в том, что здесь продукты окисления и восстановления остаются в растворе, а металл облинивается с компонентами раствора электролита.
Электродный потенциал Fe3+ /Fe2+ электрода равен:
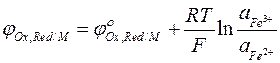
Среди редокс — электродов широкое применение получил хингидронный электрод, использующийся для определения концентрации водородных ионов в растворе. Хингидронный электрод представляет собой платиновую пластинку, опущенную в раствор, насыщенный хингидроном. Хингидрон — эквимолекулярная смесь хинона С6Н4О2 и гидрохинона С6Н4(ОН)2. Гидрохинон — слабая кислота, в незначительной степени диссоциирует на ионы:
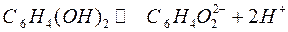
В свою очередь, ион гидрохинона может окисляться в хинон:
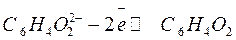 , если образующиеся при реакции электроны будут отводиться. В частности, этот процесс может быть осуществлен в гальваническом элементе. Суммарная реакция, протекающая на электроде, выражается уравнением:
, если образующиеся при реакции электроны будут отводиться. В частности, этот процесс может быть осуществлен в гальваническом элементе. Суммарная реакция, протекающая на электроде, выражается уравнением:
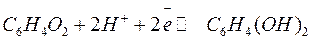 .
.
Потенциал хингидронного электрода
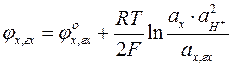 .
.
В кислых растворах степень диссоциации гидрохинона ничтожно мала и поэтому активностям хинона и гидрохинона можно считать равными (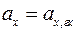 ).Тогда выражение для электродного потенциала принимает вид:
).Тогда выражение для электродного потенциала принимает вид:
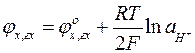
Хингидронный электрод может быть использован как измеритель рН растворов, до рН=8 и меньше.
 2015-05-10
2015-05-10 408
408








