Эти электроды представляют собой металлы, покрытые слоем малорастворимой соли металла и опущенные в раствор хорошо растворимой соли, имеющий общий анион с малорастворимой солью. Эти электроды можно рассматривать обратимыми как по отношению к катиону, так и к аниону, т.е. электродное равновесие представляет собой обмен катионом между металлом и труднорастворимой солью и обмен анионом между раствором и этой солью. Поэтому их потенциал можно выразить через активности катиона или аниона. Примерами электродов второго рода являются каломельный и хлорсеребряный электроды.
| Электрод | Устройство электрода (схематич. запись) | Электродная реакция |
| Каломельный | 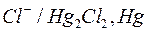
| 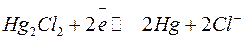
|
| Хлорсеребряный | 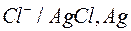
| 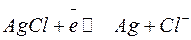
|
Если рассматривать эти электроды как обратимые по отношению к катиону, то их потенциалы можно вычислить по уравнению:
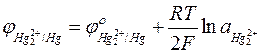 ;
;
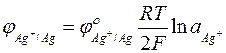 .
.
Активность ионов серебра или ртути определяется произведением активности их солей 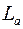 постоянной при данной температуре. Поэтому
постоянной при данной температуре. Поэтому 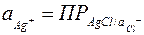 и
и 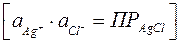
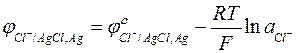 ;
;
где 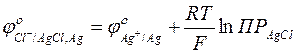
Описанные электроды второго рода отличаются постоянством потенциала и поэтому употребляются в качестве электродами они составляют гальванические элементы, в которых потенциал электрода сравнения известен. Измерив ЭДС составленного таким образом элемента, можно определить потенциал интересующего нас электрода.
 2015-05-10
2015-05-10 331
331