Метод рентгеноструктурного анализа основан на дифракции рентгеновских лучей на кристаллической решетке и поэтому применим только к веществам в кристаллическом состоянии. Это связано с тем, что для регистрации дифракционной картины рассеяния необходимо иметь достаточное количество рассеивающих электронов. Но если образец состоит из большого числа идентичных молекул, расположенных в произвольной ориентации (раствор), то картина рассеяния будет определяться какимито усредненными по всевозможным ориентациям характеристиками и вряд ли позволит получить детальную информацию об атомной структуре.
Другое дело, если большое количество одинаковых экземпляров одной и той же молекулы помещены в одной и той же ориентации. Такую возможность дают нам кристаллические образцы. Говоря простыми словами (и не вдаваясь в сложные математические формулировки), кристалл — это такой образец исследуемого вещества, в котором много (~1012) идентичных молекул находятся в одинаковой ориентации, и их центры образуют правильную трехмерную решетку.
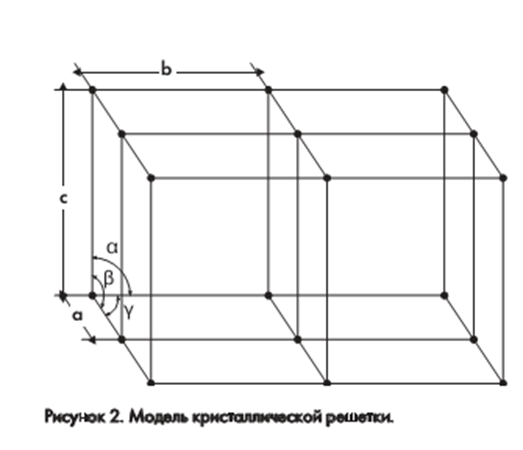
Основная особенность структуры каждого кристалла состоит в том, что он построен из регулярно расположенных в пространстве отдельных атомов или групп атомов. Если каждую повторяющуюся структурную единицу заменить точкой, или узлом, то получится трехмерная кристаллическая решетка (рисунок 2).
Решетку можно представить себе как систему одинаковых параллелепипедов. Каждый такой параллелепипед носит название «элементарная ячейка кристалла», которая описывается шестью параметрами: длинами ребер (a, b, c) и углами между ними (α, β, γ).
Одной из основных претензий к методу рентгеноструктурного анализа с самого начала исследования структур белков являлась та, что в жизни белки находятся в растворе, а при исследовании мы их кристаллизуем. Задавался логичный вопрос: не деформируется ли структура белковой глобулы при кристаллизации настолько, что структура белка в кристалле перестает иметь что бы то ни было общее со структурой белка в функционально активном состоянии? В современных исследованиях принято считать, что сильных искажений все-таки не происходит. Некоторые доводы в пользу такой позиции следующие. Во-первых, ряд белков сохраняет ферментативную активность и в закристаллизованном состоянии, т.е. структура портится не настолько, чтобы белок стал «неработоспособен». Другое соображение — в кристаллах биомакромолекул значительный объем (от 30 до 80%) занимает растворитель, т.е. упаковка молекул белка в кристалле неплотная и вряд ли вызывает существенные искажения.
Некоторые искажения в свободных петлях, наверное, возможны, но структура активного центра сохраняется. Еще одно подтверждение — альтернативное определение структур некоторых белков методом двумерного ядерного магнитного резонанса не дало существенных расхождений со структурами, расшифрованными рентгеновскими методами.
 2015-05-10
2015-05-10 396
396








