1. Масса m вещества, выделившегося при электролизе на электроде, пропорциональна заряду Q, перенесенному током через электролит.
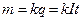 ,
,
k - электрохимический эквивалент вещества, выражающий зависимость массы выделенного при электролизе вещества от его рода. Электрохимический эквивалент измеряется массой вещества, выделяющегося на электроде при прохождении через электролит единицы, заряда.
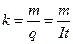
2. Электрохимические эквиваленты веществ пропорциональны их химическим эквивалентам.
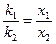 ,
,
где х =А/n
А - атомная масса вещества,
n - валентность
Отношение химического эквивалента вещества к его электрохимическому эквиваленту одинаково для всех веществ. F = x/k = const, где F - постоянная Фарадея для электролиза.
3. Объединенный закон Фарадея для электролиза.
Масса вещества, выделившегося при электролизе на электроде, пропорциональна атомной массе этого вещества, силе тока, и времени его прохождения через электролит и обратно пропорциональна валентности вещества.
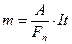
2. ХОД РАБОТЫ.
1. Взвесить одну из медных пластин, 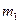 которая будет служить катодом. Заметить ее.
которая будет служить катодом. Заметить ее.
2. Собрать электрическую цепь по схеме.

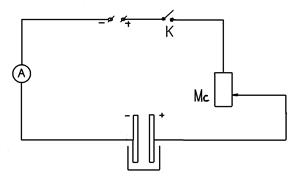
3. Заметить время, замкнуть цепь ключом, быстро установить реостатом силу тока I = 1А.
4. Следить, чтобы в продолжение всего опыта сила тока оставалась постоянной.
5. Через 20-30 минут ток выключить, вынуть пластинку, не касаясь руками отложившегося слоя меди. Осторожно ополоснуть ее водой.
6. Просушить пластинку над плиткой.
7. Снова взвесить пластинку 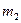 и определить массу выделившейся меди: m = m2 – m1.
и определить массу выделившейся меди: m = m2 – m1.
8. Определить k меди по формуле k = m/It, где I - сила тока, t - время прохождения тока.
9. Данные измерений занести в таблицу.
10. Сравнить полученный результат с табличным и объяснить отклонения[19].
11. Вычислить абсолютную и относительную погрешность полученного результата относительно табличного результата по формулам:[20]
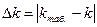 ;
; 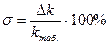 ,
,
kтабл = 3,29×10-7 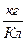 .
.
12. Сделать вывод о проделанной работе.[21]
ТАБЛИЦА РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ И ВЫЧИСЛЕНИЙ
Цена одного деления амперметра = …
| Масса пластинки до опыта. | Сила тока | Время опыта | Масса пластинки после опыта | Масса выделившейся меди | Электрохимический эквивалент меди | |
| m1, кг | I, А | t, с | 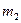 , кг , кг | m, кг | k, кг/Кл | |
КОНТРОЛЬНЫЕ ВОПРОСЫ ПЕРВОГО УРОВНЯ.
1. Какие вещества относятся к электролитам? Чем обусловлена электропроводность электролитов? Что такое электролитическая диссоциация?
2. Что представляет собой электрический ток в электролитах?
КОНТРОЛЬНЫЕ ВОПРОСЫ ВТОРОГО И ТРЕТЬЕГО УРОВНЯ.
3. Напишите и сформулируйте первый закон Фарадея для электролиза.
4. Что называют электрохимическим эквивалентом вещества? Какая формула выражает смысл этого понятия? Каковы единицы электрохимического эквивалента вещества?
5. Напишите и сформулируйте второй закон Фарадея для электролиза. Что Фарадея для электролиза?
6. Как записывают и читают объединенный закон Фарадея для электролиза?
Лабораторная работа № 11.
 2015-05-10
2015-05-10 1902
1902








