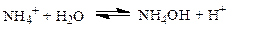 |
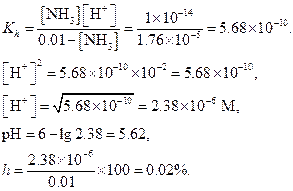
1.2.3. Соль образована слабым основанием и слабой кислотой.
 | (1.59) |
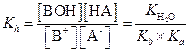 | (1.60) |
Обозначив общую концентрацию соли С М, степень гидролиза h, найдем равновесные концентрации
[В+] = [А-] = С - С × h = С × (1 - h).
Если [ВОН] = [НА] = С × k, тогда
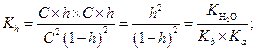 | (1.61) |
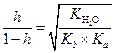 | (1.62) |
Если h << 1, в знаменателе дроби уравнения (1.62) можно величиной h пренебречь и вычислить h по формуле
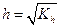 | (1.63) |
Если константа гидролиза такой соли мала, то кислотность раствора можно определить следующим образом. Приняв [НА] 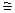 [ВОН] и [В+]
[ВОН] и [В+] 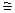 [А-]
[А-] 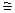 С ВА , подставляем эти значения в уравнение (1.60)
С ВА , подставляем эти значения в уравнение (1.60)
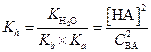 | (1.64) |
Заменив в последнем уравнении [НА] на соответствующее значение из константы диссоциации НА
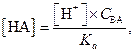 |
находим
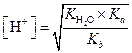 | |
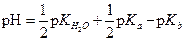 | (1.65) |
Пример 16. Вычислить h и рН 0.01 М раствора ацетата аммония.
Решение. Находим константу гидролиза Кh по уравнению (1.60)
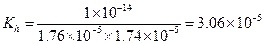 |
h найдем по уравнению (1.62)
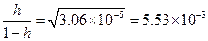 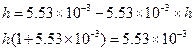 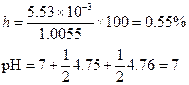 |
1.2.4. Соль образована сильным основанием и слабой двухосновной кислотой.
В растворе такой соли имеют место следующие реакции:
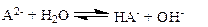 | (1.66) |
 | (1.67) |
Если 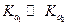 , то при расчетах учитывается только первая ступень гидролиза и, следовательно,
, то при расчетах учитывается только первая ступень гидролиза и, следовательно, 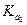 кислоты.
кислоты.
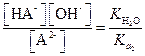 | (1.68) |
Приняв [НА-] = [ОН-], найдем
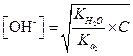 | (1.69) |
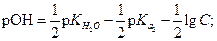 | (1.70) |
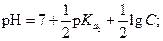 | (1.71) |
Пример 17. Вычислить h и рН 0.01 М раствор сульфита натрия.
Решение.
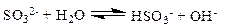 |
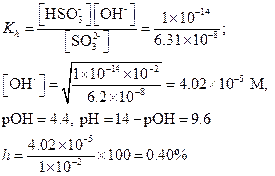 |
Реакции гидролиза можно рассматривать как протолитические реакции, в которых взаимодействующие с водой катионы или анионы соли, проявляя свойства основания или кислоты, образуют соответствующие сопряженные кислоту или основание. Например, при растворении NH4C1 в воде имеют место следующие равновесия:
 | (1.72) |
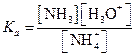 | (1.73) |
 | (1.74) |
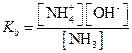 | (1.75) |
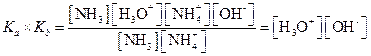 | (1.76) |
Поскольку 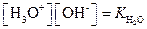
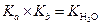 | (1.77) |
Из этого соотношения легко рассчитать Кb сопряженного основания или Ка кислоты.
Пример 18. Определить Кb аниона CN- согласно реакции
 |
Решение. Ka (HCN) равна 5×10-10, отсюда
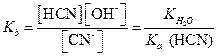 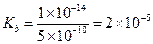 |
 2015-05-13
2015-05-13 2858
2858
