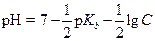При растворении солей слабых кислот или слабых оснований в воде происходит химическое взаимодействие между ионами соли и ионами воды, сопровождающееся образованием слабой кислоты или кислой соли, слабого основания или основной соли. В результате гидролиза растворы этих солей имеют кислую или щелочную реакцию.
Равновесное состояние реакции гидролиза может быть охарактеризовано степенью гидролиза соли (h) или константой гидролиза (Кh). Под степенью гидролиза подразумевают число, показывающее, какая часть от общего количества растворенной соли подвергается гидролизу.
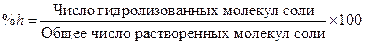
Рассмотрим различные случаи гидролиза солей.
1.2.1. Соль образована слабой кислотой и сильным основанием
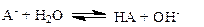 | (1.44) |
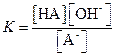 | (1.45) |
Константа равновесия этой реакции является константой гидролиза соли
| K=Kh | (1.46) |
Если общая концентрация соли была С М, а гидролизу подверглось х молей, тогда равновесные концентрации будут равны
[А-] = С - х M; [НА] = х. М, [ОН-] = х М,
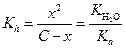 | (1.47) |
Если Kh мала и С >> х, тогда значением х в знаменателе можно пренебречь, и
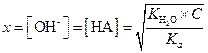 | (1.48) |
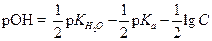 | (1.49) |
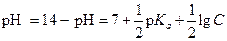 | (1.50) |
Если Kh велика и х мало отличается от С, равновесные концентрации НА и ОН- находят решением полного квадратного уравнения.
Степень гидролиза, выраженная в %, может быть найдена из следующего выражения:
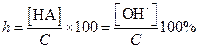 | (1.51) |
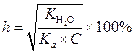 | (1.52) |
Пример 14. Вычислить h и рН 0.05 М раствора KCN (Ka = 5×10-10).
Решение.
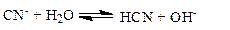 |
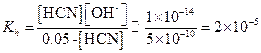
Примем [HCN] = [OH-] = x. Тогда
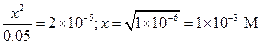
pOH = 3, pH = 14 - 3 = 11, 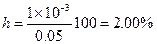
1.2.2. Соль образована сильной кислотой и слабым. основанием
 | (1.53) |
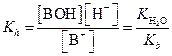 | (1.54) |
[B+] = C - x
[BOH] = [H+] = x
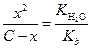 | (1.55) |
Если x << С, то
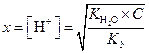 | (1.56) | ||
| (1.57) | ||
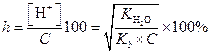 | (1.58) |
Пример 15. Вычислить h и рН 0.01 М раствора NH4NO3.
 2015-05-13
2015-05-13 1321
1321