159. Вычислить равновесную концентрацию ионов серебра в растворе, содержащем 10-3 М нитрата серебра и 0.102 М цианида калия, принимая во внимание, что в этих условиях существует в основном комплекс Ag(CN)2-
160. К 100 мл 10-3 М раствора нитрата ртути (II) добавлено 100 мл 0.64 М раствора роданида аммония. Вычислить равновесную концентрацию ионов ртути (II), учитывая, что в указанных условиях преобладает комплекс 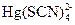 .
.
161. К 25 мл 2×10-3 М раствора хлорида ртути (II) добавлено 0.7305 г хлорида натрия. Вычислить равновесную концентрацию Hg2+, закомплексованность и долю комплекса 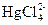
162. Вычислить закомплексованность и равновесную концентрацию Ag+ в растворе, содержащем 1×10-3 М нитрата серебра и 0.022 М аммиака. Ионная сила равна 0.5.
163. Ионы меди (II) образуют с аммиаком комплекс состава 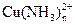 (n = 1-4). Вычислить концентрацию комплекса
(n = 1-4). Вычислить концентрацию комплекса 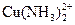 в растворе, в котором общая концентрация ионов меди (II) равна 0.001 М, а равновесная концентрация аммиака составляет 0.01 моль/л. Ионная сила равна 1.
в растворе, в котором общая концентрация ионов меди (II) равна 0.001 М, а равновесная концентрация аммиака составляет 0.01 моль/л. Ионная сила равна 1.
164. В растворе возможно существование смеси комплексов никеля состава 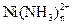 (n = 1-4).. Найти закомплексованность и концентрацию комплекса
(n = 1-4).. Найти закомплексованность и концентрацию комплекса 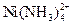 в растворе при общей концентрации ионов никеля 10-4 М, если равновесная концентрация аммиака составляет 10-3 моль/л. Ионная сила раствора равна 2.
в растворе при общей концентрации ионов никеля 10-4 М, если равновесная концентрация аммиака составляет 10-3 моль/л. Ионная сила раствора равна 2.
165. Вычислить закомплексованность и равновесную концентрацию Со2+ в 10-2 М растворе хлорида кобальта, содержащем 1.04 М аммиак. Ионная сила раствора равна 1.
166. Сколько г цианида калия необходимо добавить к 1 л 0.1 М раствора нитрата серебра, чтобы понизить концентрацию ионов серебра до 10-19 М при ионной силе 0.1. (Считать, что в данных условиях в растворе образуется комплекс 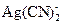 ).
).
167. Какова должна быть концентрация аммиака в растворе, содержащем 0.025 М сульфата цинка, чтобы закомплексованность была равна 1.25×106 при ионной силе, равной 2. В данных условиях образуется в основном комплекс 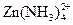 .
.
168. В присутствии избытка тиосульфата натрия в растворе соли свинца образуется комплекс 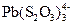 . Сколько г Na2S2O3×5H2O необходимо добавить к 200 мл 0.02 М раствора нитрата свинца, чтобы концентрация ионов свинца понизилась до 1×10-5 М, если ионная сила раствора равна 3?
. Сколько г Na2S2O3×5H2O необходимо добавить к 200 мл 0.02 М раствора нитрата свинца, чтобы концентрация ионов свинца понизилась до 1×10-5 М, если ионная сила раствора равна 3?
169. В растворе соли железа (III) в присутствии сульфосалициловой кислоты (H3L) образуются комплексы состава FeL, 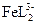 ,
, 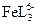 . Рассчитать равновесную концентрацию ионов железа (III) при следующих условиях: к 100 мл 10-3 М раствора Fe(NO3)3 добавлено 100 мл 0.1 М сульфосалицилата натрия (Na2HL). pH раствора равен 3, ионная сила 0.25.
. Рассчитать равновесную концентрацию ионов железа (III) при следующих условиях: к 100 мл 10-3 М раствора Fe(NO3)3 добавлено 100 мл 0.1 М сульфосалицилата натрия (Na2HL). pH раствора равен 3, ионная сила 0.25.
170. Найти закомплексованность и равновесную концентрацию Fe3+ в 10-4 М растворе соли железа (III), к которому добавлен 0.1 М оксалат натрия, рН раствора равен 4, ионная сила 0,5. В указанных условиях преобладает комплекс 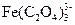 .
.
171. Найти концентрацию комплексных анионов 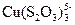 при общей концентрации ионов меди (I) 10-3 М, если равновесная концентрация
при общей концентрации ионов меди (I) 10-3 М, если равновесная концентрация 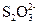 равна 10-2 М, а ионная сила 0.1.
равна 10-2 М, а ионная сила 0.1.
172. В присутствии избытка щелочи индий образует комплексные анионы состава 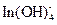 . При какой концентрации NaOH равновесная концентрация In3+ в 4×10-5 М растворе будет равна 1×10-30 М при ионной силе 0.1?
. При какой концентрации NaOH равновесная концентрация In3+ в 4×10-5 М растворе будет равна 1×10-30 М при ионной силе 0.1?
* Здесь и далее заряды для простоты опущены
 2015-05-13
2015-05-13 2740
2740







