Состояние некоторого количества вещества можно охарактеризовать, указав, например, температуру, давление – это характеристики макросостояния или указать мгновенные характеристики каждой частицы вещества – ее положение в пространстве (x i, y i, z i) и скорости перемещения по всем направлениям (v x, v y, v z) – это характеристики микросостояния вещества. Так как вещество состоит из огромного числа частиц, то данному макросостоянию отвечает огромное число микросостояний.
Число микросостояний, которое соответствует данному макросостоянию вещества, называется термодинамической вероятностью состояния системы – W.
Величина W есть число различных способов, посредством которых реализуется данное состояние вещества. Макросостояние тем вероятнее, чем большим числом микросостояний оно осуществляется. Так для системы из 10 молекул W близко к 10000. Оказалось удобнее и проще характеризовать состояние системы не самой вероятностью осуществления данного макросостояния, а величиной, пропорциональной ее логарифму. Эта величина называется энтропией и обозначается буквой S.
Как показано Больцманом,
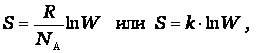
где R - универсальная газовая постоянная,
N A – постоянная Авогадро,
S – характеризует состояния системы и возможные изменения состояний, поэтому является функцией термодинамического состояния. Каждому состоянию системы соответствует определенное значение энтропии. Следовательно, вероятность различных состояний системы (газовое, жидкое, твердое) можно количественно выразить значением энтропии. Абсолютные значения энтропии можно определить экспериментально для простых и сложных веществ или взять из справочника термодинамических величин.
Если S - это функция состояния, то Δ S = S кон - S нач.
Единица измерения [ S ] = Дж моль-1 град-1.
Величину S можно рассматривать как меру неупорядоченности состояния системы, то есть как количественную меру беспорядка.
Представим в сосуде с перегородкой два инертных газа Ne и Ar.
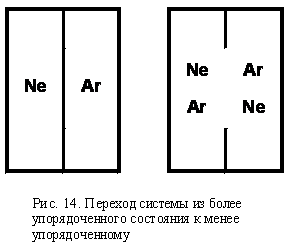
В сосуде с перегородкой состояние системы характеризуется значением энтропии S 1. После удаления перегородки молекулы самопроизвольно перемешиваются и равномерно распределяются по всему объему. Степень неупорядоченности системы возрастает и характеризуется более высоким значением энтропии S 2.
Δ S = S 2 – S 1, Δ S > 0
Обратный самопроизвольный переход системы из состояния 2 в состояние 1 невозможен. Движущей силой смешения газов является стремление перейти в более вероятное и беспорядочное состояние.
2 закон термодинамики
В изолированных системах самопроизвольно протекают только те процессы, которые сопровождаются ростом энтропии системы.
В справочниках приводится, так называемая, стандартная энтропия 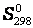 вещества, находящегося в стандартном состоянии при температуре 298,15 К. Т.к. энтропия является функцией состояния системы, то для реакции, протекающей в стандартных условиях,
вещества, находящегося в стандартном состоянии при температуре 298,15 К. Т.к. энтропия является функцией состояния системы, то для реакции, протекающей в стандартных условиях,
b B + d D = l L + m M
изменение энтропии (энтропия реакции) можно рассчитать как разницу между суммарной энтропией продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в соответствии с уравнением
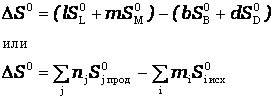 ,
,
где n j, m i – коэффициенты уравнения реакции для продуктов и исходных веществ;
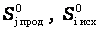 - стандартные энтропиипродуктов реакции и исходных веществ, соответственно.
- стандартные энтропиипродуктов реакции и исходных веществ, соответственно.
Энтропия растет (Δ S > 0) в процессах, связанных с повышением температуры, при плавлении вещества, при испарении, при расширении системы, растворении. В этих случаях увеличение числа частиц и энергии теплового движения увеличивает беспорядок и, следовательно, увеличивается энтропия, и наоборот – охлаждение, конденсация, кристаллизация, реакции с уменьшением объема – сопровождаются уменьшением энтропии (Δ S < 0). "Носителями" энтропии являются газы, обладающие высокими значениями энтропии.
 2015-05-13
2015-05-13 1282
1282

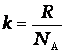 -
-