Это утверждение также называют вторым началом термодинамики.
Второе начало термодинамики указывает направление процессов в изолированных системах. Самопроизвольные процессы в изолированных процессах идут в направлении увеличения энтропии. Если изолированная система находится в состоянии с максимальной энтропией, соответствующей ее энергии, то в ней не могут происходить никакие процессы, поскольку любой процесс привел бы к уменьшению энтропии. Таким образом, состояние с максимальной энтропией является наиболее устойчивым состоянием изолированной системы.
Рассмотрим некоторые примеры.
Теплопередача. Если привести в соприкосновение два тела А и В, температуры которых соответственно равны ТA и TB, то теплота будет переходить от более нагретого тела к менее нагретому, в результате чего температуры обоих тел будут выравниваться.
Пусть Та > TB. Вычислим изменение энтропии, которым сопровождается этот необратимый процесс.
Состояние тела А изменяется при этом за счет потериим некоторого количества теплоты – δQ; соответственно тело В изменяет свое состояние за счет получения такого же количества теплоты δQ.
Для определения изменения энтропии системы, состоящей из обоих тел, нужно вычислить значения 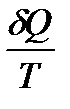 = dS для какого-нибудь обратимого процесса, приводящего к тому же изменению состояния системы. Таким процессом может служить, например, процесс передачи тепла от тела А к телу В при помощи третьего рабочего тела, как это было сделано при рассмотрении процесса Карно, который, как известно, осуществляется обратимым путем на всех стадиях. Тогда для тела А и соответственно для тела В
= dS для какого-нибудь обратимого процесса, приводящего к тому же изменению состояния системы. Таким процессом может служить, например, процесс передачи тепла от тела А к телу В при помощи третьего рабочего тела, как это было сделано при рассмотрении процесса Карно, который, как известно, осуществляется обратимым путем на всех стадиях. Тогда для тела А и соответственно для тела В
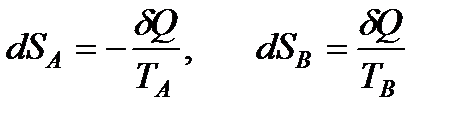 .
.
 Общее изменение энтропии обоих тел равно:
Общее изменение энтропии обоих тел равно:
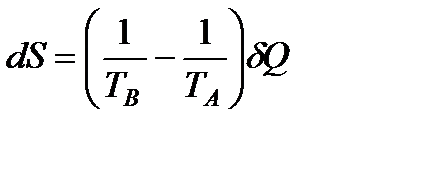
Поскольку ТA > ТB, то dS > 0, т. е. энтропия системы возрастает.
Приведенное рассуждение не зависит от того, посредством какого процесса осуществлен переход теплоты от тела А к телу В — теплопроводностью или излучением. Существенно лишь, что температуры обоих тел различны.
Изменение энтропии одного моля газа при изменении температуры и давления дается выражением:

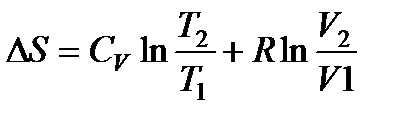 , (145)
, (145)
где T1, T2, V1, V2 – значения температуры и объема в начальном и конечном состояниях, R – газовая постоянная. Таким образом, энтропия возрастает как при увеличении температуры, так и при увеличении объема газа.
При адиабатическом расширении газа в пустоту работа не совершается и, следовательно, температура не изменяется. Однако, тем не менее, согласно формуле (145), энтропия газа повышается.
Рост энтропии при взаимной диффузии газов. Если привести в соприкосновение два различных газа, то они сами собой, без всякого внешнего воздействия, перемешаются благодаря взаимной диффузии. Обратный процесс, т. е. разделение газовой смеси на ее компоненты, сам собой не происходит и возможен только при определенном внешнем воздействии. Перемешивание газов — это необратимый процесс, и он должен поэтому сопровождаться ростом энтропии.
Действительно, представим себе, что в сосуде объемом V1 находится 1 моль некоторого идеального газа. В другом сосуде объемом V2 содержится 1 моль другого газа. Соединим вместе оба сосуда. Газы тогда смешаются и образовавшаяся смесь займет объем V = V1 + V2. Этот процесс можно рассматривать как расширение каждого из газов: первый расширился от объема V1 до объема V, второй — от объема V2 до объема V. При этом энтропия первого газа, согласно формуле (145), изменяется на величину 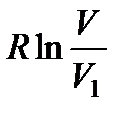 , второго — на величину
, второго — на величину 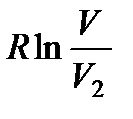 . Общее же изменение энтропии ΔS выразится равенством
. Общее же изменение энтропии ΔS выразится равенством

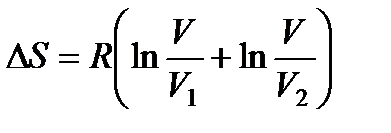 .
.
Так как и V1 и V2 меньше; чем V, то ΔS > 0, т. е. энтропия системы возросла.
 2015-02-15
2015-02-15 2993
2993
