1) обратимые процессы
Из формулы (8.3) следует:
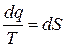 (8.5)
(8.5)
Выражение (8.5) в отличии от ранее введенного понятия энтропии, справедливо для любого рабочего тела.
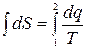 ;
; 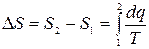 (8.6)
(8.6)
Формула (8.6) позволяет вычислить изменения энтропии в обратимых процессах.

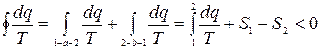
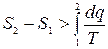 (8.7)
(8.7)
Формула (8.7) справедлива для необратимых процессов.
Если их объединить:

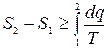
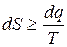 (8.8)
(8.8)
Формула (8.8) - математическое выражение второго закона термодинамики. В этом выражении знак равенства справедлив для обратимых процессов, а знак неравенства - для необратимых.
Анализ выражения (8.8):
1. Рассмотрим изолированную систему: dq = 0.
Если процессы обратимые, то dS = 0; S = const (энтропия постоянна).
Если процессы необратимые, тогда dS > 0
Следовательно, 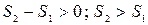 (энтропия возрастает).
(энтропия возрастает).

2. Процесс теплообмена при конечной разности температур:
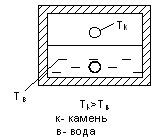
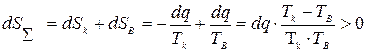
Таким образом, процесс теплообмена идет с возрастанием энтропии.
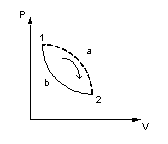
3. Тепловая машина, работающая по циклу Карно:
а) 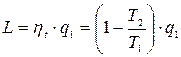
б) с выраженной необратимостью
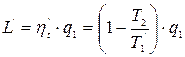
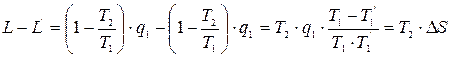
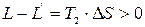 (8.9)
(8.9)
Таким образом, из (8.9) следует, что для повышения работоспособности тепловых машин эффективней всего уменьшать температуру холодильника 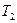 .
.
Физический смысл понятия энтропии:
1. Вобратимых процессах изменение энтропии соответствует изменению теплоты, т.е. при подводе тепла энтропия возрастает, а при отводе –убывает.
2. В необратимых процессах изменение энтропии определяет направление процессов. Реально происходят те процессы, в которых энтропия возрастает.
3. В тепловых машинах изменение энтропии определяет потерю работоспособности этих машин - (8.9)
4. Энтропия служит мерой упорядоченности системы: чем больше беспорядка, тем больше энтропия.
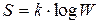 – формула Больцмана (8.10)
– формула Больцмана (8.10)
где k - константа, 
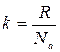
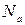 - число Авогадро
- число Авогадро
W – термодинамическая вероятность, 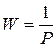 - число способов, которыми может осуществляться данное состояние.
- число способов, которыми может осуществляться данное состояние.
 2015-04-23
2015-04-23 12362
12362
