В результате углубления представлений о природе света, выяснилось, что свет обладает двойственной природой, получившей название корпускулярно-волнового дуализма света. С некоторыми объектами свет взаимодействует как электромагнитная волна, с другими - подобно потоку особых частиц (световых квантов или фотонов). То есть свет - это материальный объект, обладающий как волновыми, так и корпускулярными свойствами. В различных физических процессах эти свойства могут проявляться в различной степени. При определенных условиях, то есть в ряде оптических явлений свет проявляет свои волновые свойства (например, при интерференции и дифракции). В этих случаях необходимо рассматривать свет как электромагнитные волны. В других оптических явлениях (фотоэффект, эффект Комптона и т.д.) свет проявляет свои корпускулярные свойства, и тогда его следует представлять как поток фотонов. Иногда, оптический эксперимент можно организовать так, что свет будет проявлять в нем как волновые, так и корпускулярные свойства. Раздел физики, занимающийся изучением природы света, законов его распространения и взаимодействия с веществом, называется оптикой.
Свет - в узком смысле то же, что и видимое излучение, т. е. электромагнитные волны в интервале частот, воспринимаемых человеческим глазом (7,5-1014-4,3-1014 гц, что соответствует длинам волн λ в вакууме от 400 до 760 нм). Внутри данного интервала чувствительность глаза неодинакова, она изменяется в зависимости от воспринимаемой длины волны излучения. Наибольшей чувствительностью глаз обладает в зеленой области, что соответствует длине волны около 550 нм. Свет - в широком смысле – синоним оптического излучения, включающего, кроме видимого, излучение ультрафиолетовой УФ (10 нм < λ < 400 нм) и инфракрасной ИК областей спектра (760 нм < λ < 1 мм). Именно в оптическом диапазоне начинают отчётливо проявляться одновременно и волновые и корпускулярные свойства электромагнитного излучения.
Естественными источниками света являются Солнце, Луна, звёзды, атмосферные электрические разряды и т.д.; искусственными - устройства, превращающие энергию любого вида в энергию видимых (или оптических) излучений. Из искусственных источников света различают тепловые источники, в которых свет возникает при нагревании тел до высокой температуры, и люминесцентные, в которых свет возникает в результате превращения тех или иных видов энергии непосредственно в оптическое излучение, независимо от теплового состояния излучающего тела. Совершенно новый тип источников света представляют собой лазеры (оптические квантовые генераторы), которые дают когерентные световые пучки высоких интенсивностей, исключительной однородности по частоте и острой направленности.
Вопрос об излучении и поглощении света веществом относится не только к оптике, но и к учению о строении самого вещества (атомов и молекул).
В опытах Резерфорда (1911 год) было установлено, что атом любого химического элемента состоит из положительно заряженного ядра, вокруг которого расположены отрицательно заряженные электроны. В целом атом нейтрален. Совокупность электронов составляет электронную оболочку атома. Ядро, в котором сосредоточена почти вся масса атома, занимает ничтожно малую часть всего его объема. Диаметр ядра порядка 10-12-10-13 см. При этом размер самого атома, который определяется размерами его электронной оболочки, около 10-8 см. Опыты Резерфорда наводили на мысль о планетарной модели атома, в которой электроны (планеты) движутся вокруг ядра (Солнца) по замкнутым (например, в первом приближении по круговым) орбитам. Но в этом случае электроны будут двигаться с ускорением, и в соответствии с классической электродинамикой они должны непрерывно излучать электромагнитные (световые) волны. Процесс излучения сопровождается потерей энергии, поэтому в конечном счете электроны должны упасть на ядро, а атом прекратить свое существование. Таким образом, вопросы об устойчивости атомов и закономерностях в атомных спектрах оставались открытыми. (Cпектром излучения или поглощения называется зависимость интенсивности излучения или поглощения от частоты или длины волны света.)
Проанализировав всю совокупность опытных фактов, в 1913 году датский физик Нильс Бор пришел к выводу, что при описании атома, то есть устойчивого образования из ядра и электронов, следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять теория о строении атома.
Первый постулат: атом (электрон в атоме) может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенное значение энергии (Е1, Е2,…, Еn,….). Таким образом, энергия атома (электрона в атоме) принимает только дискретные значения, или квантуется. В стационарных состояниях атом не излучает.
Второй постулат (правило частот Бора): при переходе атома (электрона в атоме) из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант света (фотон), энергия которого равна разности энергий стационарных состояний:
Ефотона = hνnm = En - Em, (1)
где h = 6,62·10-34 Дж×с – постоянная Планка, νnm - частота излучения (поглощения). Если En > Em, то происходит испускание света; если En < Em - поглощение. Формула (1) представляет собой закон сохранения энергии.
Зная частоту νnm можно найти длину волны 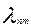 испущенной (поглощенной) электромагнитной волны:
испущенной (поглощенной) электромагнитной волны:
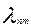
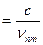 , (2)
, (2)
где с = 3·108 м/с – скорость света в вакууме.
Энергетические уровни атома и условное изображение процессов испускания и поглощения света (переходы Е3 → Е2 и Е1 → Е2 , соответственно) приведены на рис.1.
На основе предложенных постулатов Бор создал теорию простейшего атома водорода и объяснил его линейчатый спектр. Выводы в теории Бора атома водорода полностью совпадают с выводами современной квантовой физики, которая строго и адекватно описывает строение и спектры атомных систем.
В своей теории, имеющей на данный момент только историческое значение, Бор рассматривал движение электрона вокруг ядра по круговым орбитам. Им было установлено, что соответствующие стационарным состояниям атома радиусы круговых орбит rn принимают дискретные значения (в системе СГСэ):
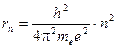 , (3)
, (3)
здесь me – масса электрона; e – его заряд; n – номер орбиты (квантовое число), которое принимает значения 1, 2, 3… и т.д.
Формулу (3) можно записать в следующем виде:
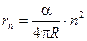 =
= 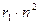 , (4)
, (4)
где
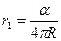 - первый (n = 1) боровский радиус, (5)
- первый (n = 1) боровский радиус, (5)
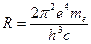 - постоянная Ридберга,
- постоянная Ридберга,  - постоянная тонкой структуры.
- постоянная тонкой структуры.
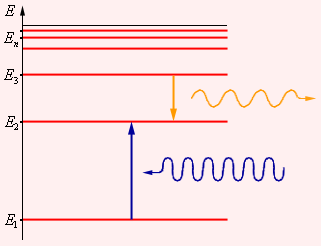
Рис. 1
Длины волн спектральных линий, испускаемых при квантовых переходах электрона в атоме водорода, определяются формулой Бальмера:
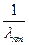 =
= 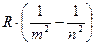 (6)
(6)
Эта формула была предложена изучавшим атомные спектры Бальмером задолго до создания квантовой механики, а впоследствии получена теоретически Бором. Здесь n и m –квантовые числа (порядковые номера) верхнего и нижнего энергетических уровней, между которыми происходит квантовый переход. Формула (6) является одной из наиболее точных формул физики. Из нее следует, что все линии спектра испускания (поглощения) атома водорода могут быть объединены в серии. Серией называется совокупность линий, испускаемых при переходах электрона с вышележащих уровней с квантовыми числами n = m+1, m+2, m+3 и т.д. на уровень с квантовым числом m = const.
На рисунке 2 представлены энеpгетические уpовни и спектральные серии атома водоpода. Слева от уровней приведены соответствующие их порядковому номеру квантовые числа. В результате pазличных пеpеходов атома водоpода с более высоких уpовней на нижние образуются серии: Лаймана (m = 1, n = 2,3,4..); Бальмера (m = 2, n = 3,4,5..); Пашена (m = 3, n = 4,5,6..); Брэккета (m = 4, n = 5,6,7..); Пфунда (m = 5, n = 6,7,8..) и т.д. Согласно формуле (1) частоты спектральных линий пpопоpциональны длинам стpелок между уровнями энергии рассматриваемых квантовых пеpеходов. Видно, что самые большие частоты (малые длины волн) соответствуют линиям сеpии Лаймана. Сеpия Лаймана целиком лежит в ультpафиолетовой области спектра электромагнитных волн. Следующая сеpия - сеpия Бальмеpа (меньшие частоты или бόльшие длины волн) попадает уже в ближнюю ультрафиолетовую и видимую область спектра. Следующая сеpия - сеpия Пашена (еще меньшие частоты) находится в ближней инфpакpасной области, а линии остальных серий - в далеком инфракрасном диапазоне.
Видимая часть линейчатого спектра атома водорода (серия Бальмера) состоит из ряда линий, наиболее яркими из которых являются следующие три: красная - Ha (n = 3), голубая - Hb (n = 4), фиолетовая - Hg (n = 5).
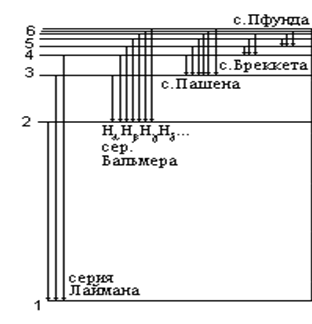
Рис. 2.
Измерив длины волн этих линий с учетом формулы (6) можно экспериментально найти значение постоянной Ридберга R:
R = 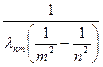 (7)
(7)
Полученное значение R позволяет по формуле (5) вычислить первый боровский радиус и оценить линейные размеры атома водорода (l ~ 2· r 1 ).
Теория Бора при описании поведения атомных систем не отвергала полностью законы классической физики. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра (в случае атома водорода - электрон вокруг ядра движется по круговым стационарным орбитам). Поэтому теорию Бора иногда называют полуклассической. Тем не менее, она сыграла огромную роль в создании атомной физики. В период ее развития (1913 - 1925 г.) были сделаны важные открытия, например, в области атомной спектроскопии. Однако, несмотря на удачное объяснение спектральных закономерностей водородоподобных атомов, которое совпадает с выводами из квантовой физики, теория Бора обладает рядом недостатков. В частности, она не может объяснить спектры излучения более сложных атомов и различную интенсивность спектральных линий. Эти трудности могут быть преодолены только квантовой теорией, учитывающей неприменимость классических представлений к микрообъектам. В то же время, постулаты Бора в приведенной выше формулировке (без указания на вращение электрона вокруг ядра по определенным орбитам) не противоречат представлениям современной физики и точно описывают стационарные состояния и квантовые переходы в атомах.
 2015-05-13
2015-05-13 2537
2537
