Определения каких-либо свойств путем измерения электродвижущих сил гальванических элементов называют потенциометрическими определениями.
Гальваническим элементом называют устройство, в котором химическая энергия преобразуется в электрическую. Он состоит из двух электродов, погруженных в растворы электролитов, между которыми устанавливают контакт с помощью электролитического мостика из насыщенного раствора KCl.
 Условная запись гальванического элемента:
Условная запись гальванического элемента:
(-) Zn / ZnSO4CdSO4 / Cd (+)
α1α2
Сплошными линиями разделены фазы; штриховой линией показан электролитический мостик; снизу обозначены активности (концентрации электролитов в растворах.
При замыкании электродов металлическим проводником происходит перенос электронов в замыкающем проводнике (по внешней цепи) и ионов в растворах (по внутренней цепи). Одновременно на отрицательном электроде протекает реакция окисления:
Zn0 – 2e → Zn2+
а на положительном – реакция восстановления:
Cd2+ +2e → Cd0
Эти реакции идут термодинамически необратимо и прекращаются c наступлением равновесия. Чем большим сопротивлением обладает соединяющий электроды проводник, тем медленнее протекают реакции на электродах.
|
|
|
Принципиально можно замкнуть электроды проводником бесконечно большого сопротивления, и реакция будет идти бесконечно медленно, так что в каждый момент времени будет существовать равновесие между электродами и раствором. Такое течение реакции является квазиобратимым. В случае термодинамически обратимого процесса получается максимальная электрическая работа. Измеренную в таких условиях разность потенциалов между электродами называют электродвижущей силой (коротко – э.д.с.) гальванического элемента.
Электрическая работа гальванического элемента равна его э.д.с. (Е), умноженной на переносимый заряд. Количество электрических зарядов, соответствующее мольным величинам, входящим в уравнение химической реакции, равно z·F, где z - число электронов, участвующих в реакции, а F - число Фарадея равное 96485 [ Кл/моль ].
Электрическая работа при изобарно-изотермическом обратимом процессе совершается за счет убыли энергии Гиббса, поэтому
– ΔG = 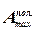 = z·F·E (1)
= z·F·E (1)
Убыль энергии Гиббса, вычисленная по уравнению (1), получится в Дж/моль.
Рассмотрим расчет константы равновесия, для реакции, лежащей в основе работы медно-цинкового элемента.
Zn + CuSO4 = Cu + ZnSO4
или в ионном виде:
Zn + Cu2+ = Cu0 + Zn2+  константа равновесия
константа равновесия 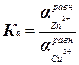
Для этой реакции уравнение изотермы можно записать:
– ΔG = R·T·ln 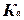 + R·T·ln (
+ R·T·ln (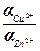 ) (2)
) (2)
Из уравнений (1) и (2) можно получить:
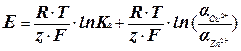 (3)
(3)
Обозначив в уравнении (3) первое слагаемое
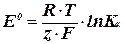 (4)
(4)
получим уравнение Нернста для э.д.с. гальванического элемента
|
|
|
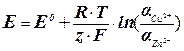 (5), где Е° – стандартная э.д.с. при активностях всех ионов в элементе равных единицам. Величина Е° может быть рассчитана по таблицам стандартных электродных потенциалов,
(5), где Е° – стандартная э.д.с. при активностях всех ионов в элементе равных единицам. Величина Е° может быть рассчитана по таблицам стандартных электродных потенциалов, 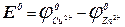 . Таким образом, константу равновесия можно определить двумя способами:
. Таким образом, константу равновесия можно определить двумя способами:
1. По найденной в опыте величине Е гальванического элемента из уравнения (3):
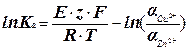 (6)
(6)
Для расчета величины активности по уравнению 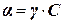 необходимо по заданной концентрации С найти коэффициент активности γ по таблицам в справочнике.
необходимо по заданной концентрации С найти коэффициент активности γ по таблицам в справочнике.
2. По таблицам стандартных электродных потенциалов найти 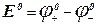 и далее из уравнения (4) получим:
и далее из уравнения (4) получим:
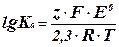 (7)
(7)
 2015-05-13
2015-05-13 686
686








