В дальнейшем нас в основном будут интересовать химические реакции, изменяющие состав самой системы.
В таких случаях 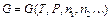
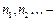 число молей всех составных частей системы.
число молей всех составных частей системы.
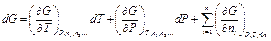
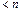 – означает постоянство масс всех компонентов, кроме i –го.
– означает постоянство масс всех компонентов, кроме i –го.
Частная производная свободной энергии Гиббса по числу молей компонента называется химическим потенциалом.
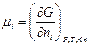 Химический потенциал в дифференциальном виде
Химический потенциал в дифференциальном виде
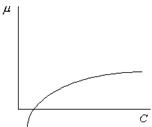
Типичная кривая зависимости химического потенциала от концентрации для разбавленных растворов на рисунке.
С увеличением С, одинаковым ее приращениям соответствуют все меньшие приращения химического потенциала.
Установлено, что при малых изменениях концентрации
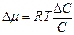
из которого вытекает, что одно и то же приращение 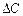 приведет при большой концентрации С к меньшему изменению
приведет при большой концентрации С к меньшему изменению 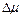 , чем при малой.
, чем при малой.
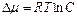
Разность химических потенциалов является величиной относительной, поэтому «нулевой уровень» потенциала при данных T и P можно выбрать произвольно. В данном случае несущественно с какого нулевого уровня ведется отсчет, а важна разность между конечными и начальными значениями.
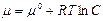
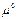 – стандартный химический потенциал.
– стандартный химический потенциал.
Рассмотрим систему, состоящую из двух фаз, между которыми распределен интересующий нас компонент. Переход массы dn из первой во вторую фазу вызовет изменение потенциала dG.
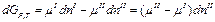
В равновесии
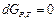
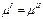
Равенство химических потенциалов это условие равновесия перехода компонента из фазы I в фазу II.
В отсутствие равновесия 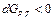 . Самопроизвольный переход будет происходить из состояния с большим химическим потенциалом в состояние с меньшим химическим потенциалом.
. Самопроизвольный переход будет происходить из состояния с большим химическим потенциалом в состояние с меньшим химическим потенциалом.
 2015-05-13
2015-05-13 680
680








