Неравновесный процесс представляет собой расщепление субстрата Х на n идентичных фрагментов Y.
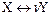
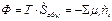
Для конкретной реакции:
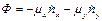
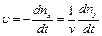
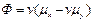
В уравнении 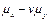 является функцией состояния, названной сродством реакции (впервые введенная Де Дондером).
является функцией состояния, названной сродством реакции (впервые введенная Де Дондером).
В более общем случае сродство определяется выражением
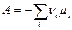
где 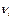 – стехиометрический коэффициент i –компонента в реакции, который берется с положительным знаком, если i –компонент является продуктом реакции, и с отрицательным знаком, если он расходуется как реагент. Поэтому уравнение удобно переписать в виде:
– стехиометрический коэффициент i –компонента в реакции, который берется с положительным знаком, если i –компонент является продуктом реакции, и с отрицательным знаком, если он расходуется как реагент. Поэтому уравнение удобно переписать в виде:
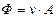
Если одновременно протекает r различных независимых реакций, то
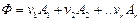
Пример
Запишем выражение диссипативноной функции для первой реакции гексозомонофосфатного пути, катализируемой гексокиназой. Этот процесс состоит из двух полуреакций, одна их которых – реакция фосфорилирования глюкозы до глюкозо–6–фосфата, вторая– реакция гидролиза АТФ.
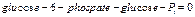
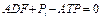
Для первой реакции изменение стандартной свободной энергии составляет 14.8 кДж/моль, тогда как для второй реакции – -30.5 кДж/моль. Даже при физиологических условиях изменение стандартной свободной энергии (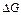 ) для первой реакции положительно, и поэтому она не может протекать самопроизвольно в сторону образования продуктов реакции. Однако, сопряжение со второй реакцией, может привести к полной диссипации свободной энергии.
) для первой реакции положительно, и поэтому она не может протекать самопроизвольно в сторону образования продуктов реакции. Однако, сопряжение со второй реакцией, может привести к полной диссипации свободной энергии.
|
|
|
Диссипативная функция для двух независимых реакций:
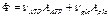
С учетом сродства реакций:
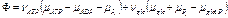
Скорости этих реакций зависимы, поскольку гексокиназа катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата только когда вторая реакция идет одновременно. Поэтому 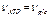
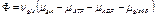
 2015-05-13
2015-05-13 676
676








