Первая состоит в том, что область (О) является закрытой системой, которая может обмениваться с областью (1) только теплом. Для такой ситуации трудно найти пример в биологии. Записывая первый закон термодинамики для области (О), получим:
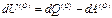
где 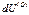 – изменение внутренней энергии области (О) в результате поглощения некоторого количества тепла
– изменение внутренней энергии области (О) в результате поглощения некоторого количества тепла 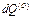 из области (1) и совершения определенного количества работы
из области (1) и совершения определенного количества работы 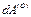 над окружающей средой (1) в процессе бесконечно малого изменения состояния. Согласно второму закону, область (О) подчиняется неравенству
над окружающей средой (1) в процессе бесконечно малого изменения состояния. Согласно второму закону, область (О) подчиняется неравенству
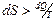 ;
; 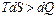
Так как мы рассматриваем реальные (необратимые) процессы, то 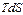 всегда больше чем
всегда больше чем 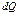 – действительно поглощенное тепло. Из этого следует, что на практике область (О) не в состоянии извлечь из своего окружения максимальное количество тепла, которое теоретически могло бы превратиться в работу. Вместо неравенства для реальных процессов можно записать:
– действительно поглощенное тепло. Из этого следует, что на практике область (О) не в состоянии извлечь из своего окружения максимальное количество тепла, которое теоретически могло бы превратиться в работу. Вместо неравенства для реальных процессов можно записать:
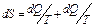 (1)
(1)
где 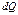 – действительное потребление тепла и
– действительное потребление тепла и 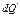 – положительная величина. По существу основой неравновесной термодинамики является вычисление величины
– положительная величина. По существу основой неравновесной термодинамики является вычисление величины 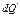 как функции соответствующих переменных. Ясно, что
как функции соответствующих переменных. Ясно, что 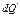 есть дополнительное тепло, которое должно было бы поглотиться из среды (1), если бы изменение происходило обратимо. При действительном изменении состояния прирост энтропии
есть дополнительное тепло, которое должно было бы поглотиться из среды (1), если бы изменение происходило обратимо. При действительном изменении состояния прирост энтропии 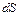 определяется также производством некоторого количества энтропии
определяется также производством некоторого количества энтропии 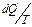 . Эта величина может представлять собой, например энтропию реакции в области (О).
. Эта величина может представлять собой, например энтропию реакции в области (О).
В неравновесной термодинамике уравнение (1) принято записывать в форме (2).
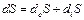 (2)
(2)
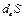 является обменным вкладом изменения энтропии в области (О), а
является обменным вкладом изменения энтропии в области (О), а 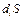 – “внутренним” вкладом, создаваемым благодаря энтропии необратимого процесса, протекающего в области (О).
– “внутренним” вкладом, создаваемым благодаря энтропии необратимого процесса, протекающего в области (О).
Вторая возможность состоит в том, что область (О) является открытой системой, которая может обмениваться с областью (1) как веществом, так и теплом. Уравнение (2) можно написать для области (О), но члены в правой части больше не будут отождествляться с соответствующими членами уравнения (1). Чтобы лучше понять смысл величины 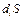 , полезно рассмотреть изменения энтропии в обеих областях системы, имея при этом в виду, что необратимый процесс возникает только в области (О). Общее изменение энтропии в такой системе равно
, полезно рассмотреть изменения энтропии в обеих областях системы, имея при этом в виду, что необратимый процесс возникает только в области (О). Общее изменение энтропии в такой системе равно
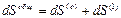 (3)
(3)
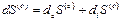 ,
, 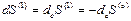 (4,5)
(4,5)
так как изменение энтропии области (1) обусловлено исключительно обменом с областью (О).
Из уравнений 3–5 следует, что
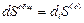
Таким образом,  представляет собой общее увеличение энтропии в окружающей среде благодаря процессам, проходящим в области (О).
представляет собой общее увеличение энтропии в окружающей среде благодаря процессам, проходящим в области (О).
 2015-05-13
2015-05-13 529
529








