Смещение равновесия при изменении температуры. В случае экзотермической
реакции (протекающей с выделением тепла) равновесие смещается влево (в сторону
исходных веществ) при повышении температуры, и вправо (в сторону продуктов
реакции) при понижений температуры: |
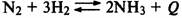
В случае эндотермической реакции (протекающей с поглощением тепла) равновесие
смещается вправо при повышении температуры и влево при понижении
температуры:

Смещение равновесия при изменении давления.
Если реакция протекает с увеличением числа молекул газообразных веществ, при
повышении давления равновесие смещается влево, а при понижении давления
вправо:
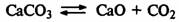
Если реакция протекает с уменьшением числа молекул газообразных веществ, то
при повышении давления равновесие смещается вправо, а при понижений давления
влево:
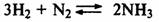
Если реакция протекает без изменения числа молекул газообразных веществ, то
при изменении давления равновесие не смещается:
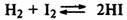
Константы равновесия рассчитывают из опытных данных, определяя равновесные концентрации исходных веществ и продуктов реакции при определенной температуре.
|
|
|
Рассмотрим разные способы смещения равновесия на примере реакции взаимодействия азота и водорода с образованием аммиака:
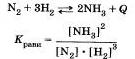
Сделаем выводы:
• при увеличении концентрации реагирующих веществ химическое равновесие системы смещается в сторону образования продуктов реакции;
• при увеличении концентрации продуктов реакции химическое равновесие системы смещается в сторону образования исходных веществ;
• при увеличении давления химическое равновесие системы смещается в сторону той реакции, при которой объем образующихся газообразных веществ меньше;
•при повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
• при понижении температуры — в сторону экзотермического процесса.
Принцип Ле Шателье применим не только к химическим реакциям, но и ко многим другим процессам: к испарению, конденсации, плавлению, кристаллизации и др. При производство важнейших химических продуктов принцип Ле Шателье и расчеты, вытекающие из закона действующих масс, дают возможность находить такие условия для проведения химического процесса, которые обеспечивают максимальный выход желаемого вещества.
2.Ацетилен – представитель углеводородов с тройной связью в молекуле.
Химические свойства, получение и применение ацетилена в органическом синтезе
Алкины – это углеводороды с общей формулой C n H2 n –2, молекулы которых содержат одну тройную связь.
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов. Молекулярная формула ацетилена C2H2.
|
|
|
Структурная формула ацетилена H–C = C–H.
Электронная формула:
H: С ::: С: Н.
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp -гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s - и p -орбитали. Таким образом, в молекуле ацетилена имеются три  -связи (одна связь C–C и две связи C–H) и две
-связи (одна связь C–C и две связи C–H) и две  -связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной
-связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной  - и двух
- и двух  -связей.
-связей.
Физические свойства. Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
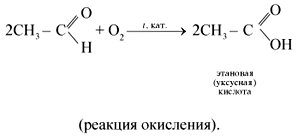
Химические свойства. По химическим свойствам ацетилен во многом аналогичен этилену. Для него характерны реакции присоединения, окисления и полимеризации.
• Реакции присоединения. Алкины присоединяют не одну, а две молекулы реагента. Тройная связь вначале переходит в двойную, а затем – в простую связь ( -связь).
-связь).
1. Присоединение водорода (реакция гидрирования) происходит при нагревании в присутствии катализатора. Реакция протекает в две стадии, сначала образуется этилен, а затем – этан:
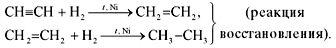
2. Присоединение галогенов (реакция галогенирования) протекает очень легко (также в две стадии):
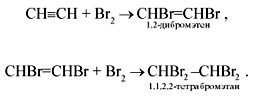
Бромная вода при этом обесцвечивается. Обесцвечивание бромной воды служит качественной реакцией на ацетилен, как и на все непредельные углеводороды.
3. Присоединение галогеноводородов (реакция гидрогалогенирования). Важное значение имеет реакция присоединения хлороводорода:
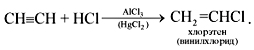
Из винилхлорида получают полимер – поливинилхлорид.
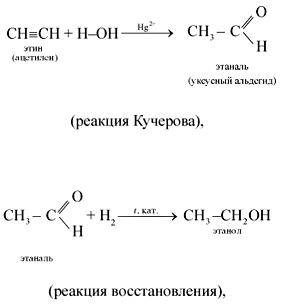
4. Присоединение воды (реакция гидратации) протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:
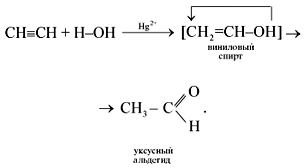
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
• Реакции окисления. Ацетилен очень чувствителен к окислителям.
1. При пропускании через раствор перманганата калия ацетилен легко окисляется, а раствор KMnO4обесцвечивается:
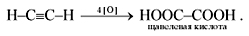
Обесцвечивание перманганата калия может быть использовано как качественная реакция на тройную связь.
При окислении обычно происходит расщепление тройной связи и образуются карбоновые кислоты:
R–C = C–R' + 3[O] + H2O —> R–COOH + R'–COOH.
Ацетилен при полном сгорании образует оксид углерода(IV) и воду:
2C2H2 + 5O2 —> 4CO2 + 2H2O.
На воздухе ацетилен горит сильно коптящим пламенем.
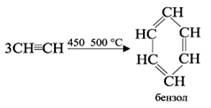
• Реакции полимеризации. В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
1. При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Под действием водного раствора CuCl и NH4Cl ацетилен димеризуется, образуя винилацетилен:

Винилацетилен обладает большой реакционной способностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:
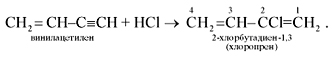
Получение ацетилена. В лаборатории и в промышленности ацетилен получают взаимодействием карбида кальция с водой (карбидный способ):
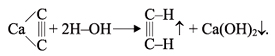
Карбид кальция получают в электропечах при нагревании кокса с негашеной известью:
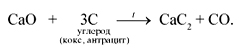
На получение CaC2 затрачивается много электроэнергии, поэтому карбидный метод не может удовлетворить потребности в ацетилене.
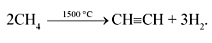
В промышленности ацетилен получают в результате высокотемпературного крекинга метана:
Применение ацетилена в органическом синтезе. Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и 1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
|
|
|
Примеры промышленного использования ацетилена:
3. При сгорании аммиака в избытке кислорода образовался азот и водяной пар. Рассчитайте суммарный объем (н. у.) продуктов, если в реакцию вступило 12,35 л аммиака.

БИЛЕТ 6
1. Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) – сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т.е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
n2 – n1 Δn Δс
υ = –––––––––– = –––––––– = –––––––– (1)
(t2 – t1) • v Δt • v Δt
где c = n/v – концентрация вещества,
Δ (читается «дельта») – общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль сернúстого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO2 + O2 = 2SO3
Скорость по кислороду будет: υ = 1: (10 • 1) = 0,1 моль/л·с
Скорость по сернúстому газу: υ = 2: (10 • 1) = 0,2 моль/л·с – это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt • S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
твердое вещество с другим твердым, жидкостью или газом,
две несмешивающиеся жидкости,
жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
между хорошо смешивающимися жидкостями,
газами,
веществами в растворах.
 2015-05-13
2015-05-13 4391
4391
