1 Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения (изменение концентрации реагентов, температуры, давления). Химические реакции, протекающие в одном направлении, называют необритимыми.
Большинство химических реакций являются обритимыми. Эта значит, что при одних и тех же условиях протекают и прямая, и обратная реакции (особенно если речь идет о замкнутых системах).
Taк как со временем концентрации веществ уменьшается, то и скорость прямой реакции тоже уменьшается.
Рано или поздно будет достигнуто состояние, при котором скорости прямой и обдотной реакций станут равными V-> = <-V.
Состояние системы, при котором скорость прямой реакции равна скорости обратной рекции, называют химическим равновесием.
Необратимые реакции протекают до полного расходования одного из исходных
веществ, т. е. если одно из получающихся веществ выпадает в осадок или
выделяется в виде газа:
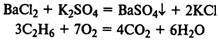
Обратимые реакции протекают до достижения состояния химического равновесия.
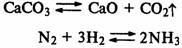
Химическое равновесие — состояние, при котором скорости прямой и обратной реакций равны.
Обратимые реакции протекают до достижения состояния равновесия.
Обратимость многих реакций кажущаяся. Так, реакция водорода с кислородом с
образованием воды кажется обратимой. Однако при температуре 2000°С с заметной
скоростью протекает обратный процесс — разложение воды на водород и кислород
и устанавливается равновесие.
Смещение химического равновесия при изменении условий описывается принципом
Ле-Шателье.
 2015-05-13
2015-05-13 4420
4420
