Ароматические углеводороды, или арены, – это соединения углерода с водородом, в молекулах которых содержится бензольное кольцо, или ядро, – циклическая группа атомов углерода с особым характером связей.
Простейшим представителем аренов является бензол C6H6. Гомологический ряд бензола имеет общую формулу C n H2 n -6.
Первую структурную формулу бензола предложил в 1865 г. немецкий химик Ф.А. Кекуле:
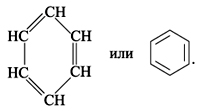
Атомы С в молекуле бензола образуют правильный плоский шестиугольник, хотя часто его рисуют вытянутым.
Приведенная формула правильно отражает равноценность шести атомов С, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, он не проявляет склонности к реакциям присоединения: не обесцвечивает бромную воду и раствор перманганата калия, т.е. ему не свойственны типичные для непредельных соединений качественные реакции.
В структурной формуле Кекуле – три одинарные и три двойные чередующиеся углерод-углеродные связи. Но такое изображение не передает истинного строения молекулы. В действительности углерод-углеродные связи в бензоле равноценны. Это объясняется электронным строением его молекулы.
|
|
|
Каждый атом С в молекуле бензола находится в состоянии sp 2-гибридизации. Он связан с двумя соседними атомами С и атомом Н тремя  -связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все
-связями. В результате образуется плоский шестиугольник, где все шесть атомов С и все  -связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o). Третья p -орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p -орбитали соседних атомов С перекрываются над и под плоскостью кольца. В результате шесть p -электронов (всех шести атомов С) образуют общее
-связи С–С и С–Н лежат в одной плоскости (угол между связями С–С равен 120o). Третья p -орбиталь атома углерода не участвует в гибридизации. Она имеет форму гантели и ориентирована перпендикулярно плоскости бензольного кольца. Такие p -орбитали соседних атомов С перекрываются над и под плоскостью кольца. В результате шесть p -электронов (всех шести атомов С) образуют общее  -электронное облако и единую химическую связь для всех атомов С.
-электронное облако и единую химическую связь для всех атомов С.
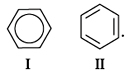
 -Электронное облако обусловливает сокращение расстояния между атомами С. В молекуле бензола они одинаковы и равны. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С).
-Электронное облако обусловливает сокращение расстояния между атомами С. В молекуле бензола они одинаковы и равны. Значит, в молекуле бензола нет чередования простых и двойных связей, а существует особая связь – “полуторная” – промежуточная между простой и двойной, так называемая ароматическая связь. Чтобы показать равномерное распределение p-электронного облака в молекуле бензола, корректнее изображать ее в виде правильного шестиугольника с окружностью внутри (окружность символизирует равноценность связей между атомами С).
Однако часто пользуются и формулой Кекуле с указанием двойных связей (II), помня, однако, о ее недостатках:
Физические свойства. Бензол – бесцветная, летучая, огнеопасная жидкость со своеобразным запахом. В воде практически нерастворим, но служит хорошим растворителем для многих органических веществ. Горит сильно коптящим пламенем (92,3 % массы приходится на углерод). Пары бензола с воздухом образуют взрывчатую смесь. Жидкий бензол и пары бензола ядовиты. Температура кипения бензола 80,1 °С. При охлаждении он легко застывает в белую кристаллическую массу с температурой плавления 5,5 °С.
|
|
|
Химические свойства. Ядро бензола обладает большой прочностью. Этим и объясняется склонность аренов к реакциям замещения. Они протекают легче, чем у предельных углеводородов.
Реакция замещения (ионный механизм).
1) Галогенирование. Бензол взаимодействует с бромом и хлором только в присутствии катализаторов:
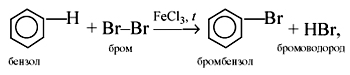
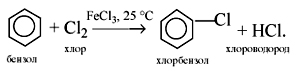
2) Нитрование. При действии на бензол нитрующей смеси (смесь концентрированных азотной и серной кислот) атом водорода замещается нитрогруппой NO2:
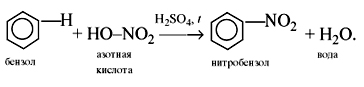
Реакции присоединения к бензолу приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
Бензол не присоединяет галогеноводороды и воду.
1) Гидрирование. Бензол присоединяет водород при низкой температуре в присутствии катализатора – никеля или платины, образуя циклогексан:
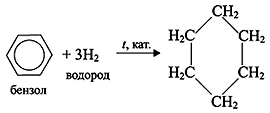
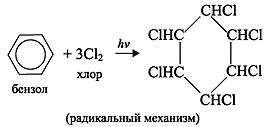
2) Галогенирование. Бензол при ультрафиолетовом облучении присоединяет хлор, образуя гексахлорциклогексан (гексахлоран):
Реакции окисления.
1) Бензол очень устойчив к окислителям. В отличие от непредельных углеводородов он не обесцвечивает бромную воду и раствор KMnO4.
2) Бензол на воздухе горит коптящим пламенем:
2C6H6 + 15O2 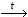 12CO2
12CO2  + 6H2O.
+ 6H2O.
Арены, таким образом, могут вступать как в реакции замещения, так и в реакции присоединения, однако условия этих превращений значительно отличаются от аналогичных превращений предельных и непредельных углеводородов. Эти реакции бензола внешне схожи с реакциями алканов и алкенов, но протекают по другим механизмам.
 2015-05-13
2015-05-13 45762
45762
