Уравнение состояния газа – функциональная зависимость между давлением 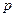 , удельным объёмом
, удельным объёмом 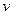 и температурой
и температурой 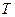 , которая существует для всех газов, находящихся в состоянии термодинамического равновесия, то есть
, которая существует для всех газов, находящихся в состоянии термодинамического равновесия, то есть 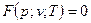 .
.
Графически эта зависимость изображается семейством изотерм.
При температуре большей критической газ всегда остаётся в газообразном состоянии при любом давлении. При температуре меньшей критической, при сжатии газа, если достигается некоторого удельного объёма 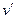 начинается конденсация газа, и он переходит в двухфазное состояние. При достижении некоторого удельного объёма
начинается конденсация газа, и он переходит в двухфазное состояние. При достижении некоторого удельного объёма 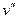 конденсация газа прекращается, и он приобретает свойства жидкости.
конденсация газа прекращается, и он приобретает свойства жидкости.
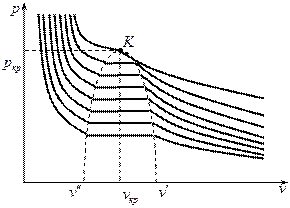 Уравнение состояния идеального газа описывается уравнением Менделеева-Клапейрона:
Уравнение состояния идеального газа описывается уравнением Менделеева-Клапейрона: 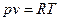 ,
, 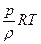 или
или 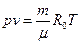 , где
, где 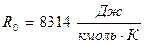 .
.
Газовая постоянная 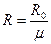 ,
, 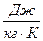 .
.
Для метана, имеющего молярную массу 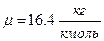 , газовая постоянная равна
, газовая постоянная равна 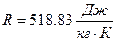 .
.
При больших давлениях и температурах характерных для магистральных газопроводов используются различные модели реальных газов, который обладает явлением сверхсжимаемости. Эти модели описываются скорректированным уравнением Менделеева-Клайперона: 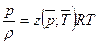 , где
, где 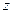 - коэффициент сверхсжимаемости, который для реальных газов всегда меньше единицы;
- коэффициент сверхсжимаемости, который для реальных газов всегда меньше единицы; 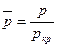 - приведённое давление;
- приведённое давление; 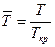 - приведённое давление.
- приведённое давление.
Для вычисления коэффициента сверхсжимаемости существуют различные эмпирические формулы, такие как 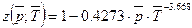 .
.
Характерные параметры компонентов природного газа:
| Название компонента | 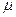 , , 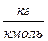
| 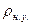 , , 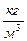
| 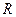 , , 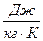
| 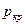 , , 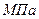
| 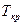 , , 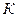
|
Метан 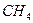
| 16.042 | 0.717 | 518.33 | 4.641 | 190.55 |
Этан 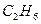
| 30.068 | 1.356 | 276.50 | 4.913 | 305.50 |
Пропан 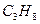
| 44.094 | 2.019 | 188.60 | 4.264 | 369.80 |
Азот 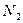
| 28.016 | 1.251 | 296.70 | 3.396 | 126.2 |
Сероводород 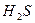
| 34.900 | 1.539 | 238.20 | 8.721 | 378.56 |
Углекислый газ 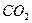
| 44.011 | 1.976 | 189.00 | 7.382 | 304.19 |
| Воздух | 28.956 | 1.293 | 287.18 | 3.180 | 132.46 |
 2015-05-13
2015-05-13 711
711








