Всякое вещество может находится в трех агрегатных состояниях -твердом, жидком и газообразном.
Кристаллическое состояние прежде всего характеризуется определенным, закономерным расположением атомов в пространстве.
В кристалле каждый атом имеет одно и то же количество ближайших атомов - соседей, расположенных на одинаковом от него расстояние.
 |
Расположение атомов в кристалле изображается в виде пространственных схем, в виде так называемых кристаллических ячеек. Под элементарной кристаллической ячейкой подразумевается наименьший комплекс атомов, который при многократном повторение в пространстве позволяет воспроизвести пространственную кристаллическую решетку.
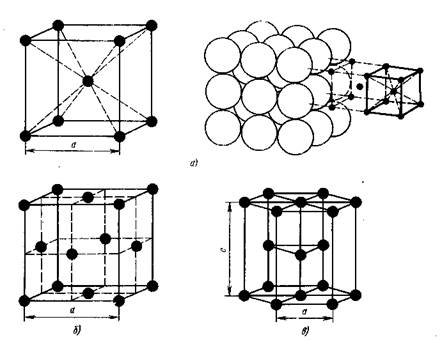
Простейшим типом кристаллической ячейки является кубическая решетка. В простой кубической решетке атомы расположены (упакованы) недостаточно плотно.
Рис.1. Типы кристаллической ячейки:
а - кубическая объемно-центрированная, б – кубическая гранецентрированная; с - гексагональная плотноупакованная
|
|
|
Стремление атомов металла занять места, наиболее близкие друг к другу, приводят к образованию решеток следующих типов (рис. 1): кубической объем-ноцентрированной, кубической гранецентрированной и гексагональной плотноупакованной (рис.1).
В кубической объемно-центрированной решетки (ОЦК) атомы расположены в углах куба и один атом в центре объема куба. в гранецентрированной кубической решетке (ГЦК) -атомы расположены в углах куба и в центре каждой грани, в гексагональной решетке атомы расположены в углах и центре шестигранных оснований призмы и три атома в средней плоскости призмы.
Кубическую ОЦК решетку имеют металлы:Na, Li, W, V, Cr и др. Кубическую ГЦК решетку имеют Pb, Ni, Ag, Au, Cu и др.
Размеры кристаллической решетки характеризуются параметрами, или периодами решетки. Кубическую решетку определяет один параметр - длина ребра куба. Параметры имеют величины порядка атомных размеров и измеряются в ангстремах.
Некоторые металлы имеют тетрагональную решетку; она характеризуется тем, что ребро с не равно ребру а. Отношение этих параметров характеризует так называемую степень тетрагональности. Число атомов, находящихся на наиболее близком расстояние от данного атома, называется координационным числом. Так например, атом в простой кубической решетке имеет шесть ближайших равноотстоящих соседей, т.е. координационное число этой решетки равно 6 (рис. 2).
Центральный атом в объемноцентрированной решетке имеет восемь ближайших равноотстоящих соседей, т.е. координационное число этой решетки равно 8. Координационное число для гранецентрированной решетки равно 12. В случае гексагональной плотноупакованной решетки координационное число равно 12.
 2015-05-30
2015-05-30 835
835








